Жизнь растений
Азотфиксирующие бактерии
Среди процессов, от которых зависит биологическая продуктивность на земном шаре, одним из важнейших является фиксация микроорганизмами азота атмосферы. Проблема биологической азотфиксации относится к числу основных проблем сельскохозяйственной и биологической науки. Перед учеными стоит задача изыскать возможности управления процессом азотфиксации и на этой основе увеличить урожайность сельскохозяйственных культур.
Биологический азот может служить существенным дополнением азотного фонда почвы, способствуя повышению ее плодородия и обеспечивая тем самым более экономное расходование технического азота — азота удобрений.
В земной коре общее содержание азота (молекулярного и в виде соединений) достигает 0,04% (по массе). Основная масса азота на Земле находится в атмосферном воздухе; 78% воздуха — чистый молекулярный азот. В количественном выражении это составляет 4*1015 т.
Ни человек, ни животные, ни растения не могут потреблять молекулярный азот, которым изобилует воздушный океан. Столб воздуха над одним гектаром земной поверхности содержит 80 000 т азота. Если бы растения могли его усваивать, этого запаса было бы достаточно для получения 30 ц зерновых с 1 га в течение более полумиллиона лет. Однако растениям нужен азот минеральных соединений, и, «купаясь» в молекулярном азоте, они могут испытывать «азотный голод».
Содержание доступного растениям азота в почве обычно невелико. Поэтому повышение урожайности сельскохозяйственных растений связано в первую очередь с улучшением их азотного питания.
По примерным подсчетам, для сельскохозяйственной продукции земного шара требуется ежегодно около 100 —110 млн. т азота. С минеральными удобрениями вносится лишь около 30% азота.
Дефицит азота в значительной степени компенсируется биологическим путем, в основном за счет запаса азота, аккумулированного в почве микроорганизмами, в первую очередь азотфиксирующими.
К 2000 г. на Земле будет вырабатываться в год примерно 100 млн.т азотных удобрений. Следует думать, что урожаи к этому времени удвоятся и будут выносить из почвы до 200 млн. т азота. Следовательно, и тогда роль микробиологического фактора в азотном обеспечении сельскохозяйственных растений останется весьма значительной.
Химическая промышленность СССР по выработке минеральных удобрений находится на одном из первых мест в мире. Однако огромная территория сельскохозяйственного использования не позволяет в достаточной мере обеспечить все культуры элементами минерального питания, в том числе и азотом. Поэтому в соответствующих количествах он дается лишь для технических культур.
В СССР при существующих урожаях за год сельскохозяйственная продукция выносит из почвы около 10 млн. т азота. В то же время применение минеральных азотных удобрений у нас не превышает пока 4 млн. т, а органические дают около 2,5 млн. т азота. Так как минеральные удобрения используются растениями далеко не полностью (на 60—70%), то ежегодный дефицит возврата азота составляет не менее 4—5 млн. т.
В ближайшие годы химическая промышленность существенно увеличит выпуск минеральных удобрений. В 1975 г. продукция азотных туков должна возрасти вдвое и зерновые культуры будут получать больше азота в форме минеральных соединений. Это позволит повысить средний урожай примерно до 20 ц/га. Однако и тогда минеральные и органические удобрения не будут компенсировать выноса азота из почвы.
Признавая, таким образом, несомненную необходимость химизации земледелия, нельзя забывать о возможности и целесообразности самого широкого использования биологического азота. Это связано и с улучшением кормовой базы, так как симбиотические азотфиксаторы обеспечивают животноводство дешевым белковым кормом (люцерна, клевер и другие виды бобовых культур).
Выдающийся русский ученый, основатель советской агрохимии Д. Н. Прянишников отметил, что, как бы ни было высоко развито производство минеральных удобрений, никогда не следует забывать о целесообразности использования биологического азота.
В ряде районов черноземной зоны, где почвы возделываются уже более 300 лет, вполне удовлетворительные урожаи получают и без внесения минеральных удобрений. По расчетам же, за это время почвы должны были бы потерять весь находящийся в них азот. В том, что этого не происходит, заслуга азотфиксаторов.
Существуют две группы фиксирующих атмосферный азот микроорганизмов. Одна из них находится в симбиозе с высшими растениями, образуя клубеньки на корнях. К этой группе относятся клубеньковые бактерии. Микроорганизмы другой группы обитают в почве независимо от растений. К ним относятся азотобактер, клостридиум, бейеринкия и другие свободно-живущие микроорганизмы. Потенциальные возможности симбиотических азотфиксаторов значительно выше, чем свободноживущих.
История открытия азотфиксирующих бактерий
Проблема биологического азота возникла с развитием земледельческой культуры. Издавна из практической агрономической деятельности человека было известно, что бобовые растения повышают плодородие почвы. Еще в III — I вв. до н. э. об этом писали греческий философ Теофраст и римляне Катон, Варрон, Плиний и Вергилий.
Первое научное объяснение способности бобовых растений накапливать азот принадлежит французскому агрохимику Дж. Буссенго (1838). Он установил, что люцерна и клевер обогащают почву азотом, зерновые же и корнеплоды истощают. Эти факты он связал со способностью бобовых растений фиксировать азот из воздуха. Однако Буссенго ошибочно представлял, что агентом фиксации являются листья бобового растения. Именно это неправильное заключение через 15 лет привело Буссенго к отрицанию своего открытия.
Стремясь более веско доказать правоту своей мысли, Буссенго провел серию опытов. В отличие от проводимых им ранее экспериментов он на прокаленном песке выращивал теперь уже не проростки бобовых растений, пересаженных с поля, а тщательно промытые семена (люпин и бобы); сосуды с растениями помещались при этом под стеклянный колпак. В таких условиях обогащения растений «воздушным азотом» не произошло. Сейчас это понятно и легко объяснимо.
Именно тщательность постановки опыта, которая исключала возможность заражения корневой системы проростков клубеньковыми бактериями, привела Буссенго к результатам, опровергшим прежние его данные. Считая тем не менее последние опыты более достоверными и не предполагая даже о существовании клубеньковых бактерий, он признал результаты прежних опытов ошибочными и отрекся от них.
Понадобилось несколько десятилетий, прежде чем удалось установить, что молекулярный азот бобовые растения фиксируют только в симбиозе с микроорганизмами, вызывающими образование клубеньков на их корнях.
Русские естествоиспытатели XIX в. М. С. Воронин, П. С. Коссович, К. А. Тимирязев внесли большой вклад в раскрытие причин, вызывающих обогащение почвы азотом при выращивании бобовых растений. Агрономические и микробиологические исследования, проведенные в те же годы рядом зарубежных авторов, также способствовали установлению этой истины.
Огромный опыт, накопившийся к настоящему времени, свидетельствует о большой роли бобовых растений в плодородии почв. Прянишников указывает, что после введения в Европе севооборотов с посевом клевера средняя урожайность зерновых повысилась с 7 до 17 ц на 1 га. В Московской сельскохозяйственной академии им. К. А. Тимирязева урожаи ржи в шестипольном севообороте с клевером однолетнего пользования на протяжении 50 лет без внесения минеральных удобрений сохраняются на уровне 14 га на 1 га, а без клевера урожай достигает лишь 7 ц. На более плодородных почвах при хорошей агротехнической обработке бобовые растения повышают урожайность еще больше.
Поэтому не удивительно, что в странах с высокоразвитым земледелием обычно до 20— 25% окультуренной площади занято бобовыми растениями. При этом одновременно можно получить и ценный корм — зеленую массу растений, и обогащение почвы азотом.
Бобовые растения играют, по-видимому, главную роль в связывании молекулярного азота в возделываемых почвах. Однако неправильно было бы думать, что все виды бобовых растений в равной степени обогащают почву. Общее увеличение количества азота в надземной массе и пожнивных остатках при культивировании люпина составляет 150—200 кг, клевера красного — 180 кг, люцерны — 300 кг, донника — 150 кг, зерновых бобовых — 50 — 60 кг азота в год на 1 га почвы. При этом прибыль азота в почве для всех перечисленных видов, за исключением зерновых бобовых, составляет примерно 50—70 кг на 1 га.
В настоящее время известно также свыше 200 различных видов других растений, для которых способность фиксировать азот в симбиозе с микроорганизмами, образующими клубеньки на корневой системе или на их листьях, вполне доказана. Большинство из них относится к деревьям и кустарникам.
Около 80 лет назад С. Н. Виноградский выделил из почвы анаэробную бактерию Clostridium pasteurianum, фиксирующую газообразный азот. Несколько позднее голландский исследователь М. Бейеринк открыл аэробную азотфиксирующую бактерию Azotobacter.
В дальнейшем список азотфиксаторов пополнился новыми видами микроорганизмов — представителей других систематических групп.
Деятельность всех свободноживущих азот-фиксирующих бактерий в почве ограничена недостатком органических веществ. Поэтому они и не могут обеспечить значительного накопления азота (в среднем они накапливают не более 5 кг азота на 1 га). Их деятельность можно активировать внесением свежего органического вещества.
Прянишников считал, что дефицит азота в 13—14 кг на 1 га компенсируется деятельностью свободноживущих азотфиксаторов и поступлением соединений азота с дождевыми водами.
Слабая эффективность свободноживущих азот-фиксирующих микроорганизмов в природных условиях подтверждается многолетней практикой земледелия в СССР, Англии, Западной Европе. Без введения в севооборот бобовых культур фиксировать азот могут только свободноживущие микроорганизмы, стабилизирующие урожай, но не обеспечивающие высокого уровня азотфиксации.
Полноценное использование в сельском хозяйстве как симбиотических, так и свободно-живущих азотфиксирующих микроорганизмов возможно только при всестороннем познании факторов, определяющих фиксацию молекулярного азота, и установлении путей интенсификации этого процесса. Возможны два пути интенсификации накопления биологического азота — расширение посевов бобовых культур и создание агротехнических условий, обеспечивающих максимальную азотфиксирующую активность симбиотических и свободноживущих азотфиксаторов.
Для успешного решения проблемы интенсификации накопления биологического азота надо увеличивать посевные площади для бобовых культур, проводить углубленную исследовательскую работу по изучению вопросов эффективной азотфиксации симбиотическими и сво-бодноживущими микроорганизмами.
Клубеньковые бактерии бобовых
Данные палеонтологии свидетельствуют о том, что самыми древними бобовыми культурами, имевшими клубеньки, были некоторые растения, принадлежащие к группе Eucaesalpinioideae.
У современных видов бобовых растений клубеньки обнаружены на корнях многих представителей семейства Рарilijоnасеае.
Филогенетически более примитивные представители таких семейств, как Caesalpiniaceae Mimosaceae, в большинстве случаев клубеньков не образуют.
Из 13 000 видов (550 родов) бобовых растений наличие клубеньков выявлено пока только приблизительно у 1300 видов (243 рода). Сюда в первую очередь относятся виды растений, использующиеся в сельском хозяйстве (более 200).
Сформировав клубеньки, бобовые растения приобретают способность усваивать атмосферный азот. Однако они способны питаться и связанными формами азота — солями аммония и азотной кислоты. Лишь одно растение — копеечник (Hedysarum coronarium) — ассимилирует только молекулярный азот. Поэтому без клубеньков в природе это растение не встречается.
Клубеньковые бактерии снабжают бобовое растение азотом, который фиксируют из воздуха. Растения же, в свою очередь, поставляют бактериям продукты углеводного обмена и минеральные соли, необходимые им для роста и развития.
В 1866 г. известный ботаник и почвовед М. С. Воронин увидел в клубеньках на корнях бобовых растений мельчайшие «тельца». Воронин выдвинул смелые для того времени предположения: он связал образование клубеньков с деятельностью бактерий, а усиленное деление клеток ткани корня с реакцией растения на проникшие в корень бактерии.
20 лет спустя голландский ученый Бейеринк выделил из клубеньков гороха, вики, чины, фасоли, сераделлы и лядвенца бактерии и изучал их свойства, проверив способность заражать растения и вызывать образование клубеньков. Он назвал эти микроорганизмы Bacillus radicicola. Поскольку к роду Bacillus относятся бактерии, образующие споры, а клубеньковые бактерии лишены этой способности, А. Пражмовский переименовал их в Bacterium radicicola. Б. Франк предложил более удачное родовое название клубеньковых бактерий — Rhizobium (от греч. rhizo — корень, bio — жизнь; жизнь на корнях). Это название привилось и используется в литературе до сих пор.
Для обозначения вида клубеньковых бактерий принято к родовому названию Rhizobium добавлять термин, соответствующий латинскому названию того вида растения, из клубеньков которого они выделены и на котором могут образовывать клубеньки. Например, Rhizobium trifolii — клубеньковые бактерии клевера, Rhizobium lupini — клубеньковые бактерии люпина и т. д. В тех случаях, если клубеньковые бактерии способны образовывать клубеньки на корнях разных видов бобовых растений, т. е. вызывать так называемое перекрестное заражение, видовое название является как бы собирательным — в нем отражена именно эта «перекрестно заражающая» способность. Например, Rhizobium leguminosarum — клубеньковые бактерии гороха (Pisum), чечевицы (Lens), чины (Lathyrus).
Морфология и физиология клубеньковых бактерий
Для клубеньковых бактерий характерно поразительное разнообразие форм — полиморфность. На это обращали внимание многие исследователи, изучая клубеньковые бактерии в чистой культуре в лабораторных условиях и почве. Клубеньковые бактерии могут быть палочковидными и овальными. Среди этих бактерий встречаются также фильтрующиеся формы, L-формы, кокковидные неподвижные и подвижные организмы.
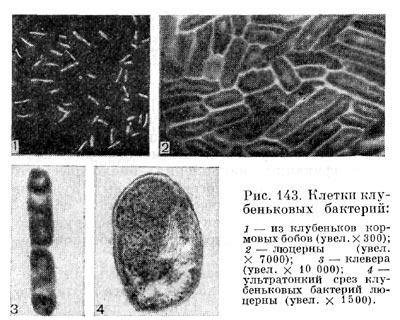
Молодые клубеньковые бактерии в чистой культуре на питательных средах обычно имеют палочковидную форму (рис. 143, 2, 3), размер палочек примерно 0,5—0,9 X 1,2—3,0 мкм, подвижные, размножаются делением. У палочковидных клеток клубеньковых бактерий клевера наблюдается деление перешнуровыванием. С возрастом палочковидные клетки могут переходить к почкованию. По Граму клетки окрашиваются отрицательно, ультратонкая структура их типична для грамотрицательных бактерий (рис. 143, 4).
При старении клубеньковые бактерии теряют подвижность и переходят в состояние так называемых опоясанных палочек. Такое название они получили вследствие чередования в клетках плотных и неплотных участков протоплазмы. Полосатость клеток хорошо выявляется при просмотре в световом микроскопе после обработки клеток анилиновыми красителями. Плотные участки протоплазмы (пояски) прокрашиваются хуже, чем промежутки между ними. В люминесцентном микроскопе пояски светло-зеленые, промежутки между ними не светятся и выглядят темными (рис. 143, 1). Пояски могут располагаться в середине клетки или на концах. Опоясан-ность клеток видна и на электроннограммах, если препарат перед просмотром не обрабатывать контрастирующими веществами (рис. 143, 3). Вероятно, с возрастом бактериальная клетка наполняется жировыми включениями, не воспринимающими окраску и вследствие этого обусловливающими исчерченность клетки. Стадия «опоясанных палочек» предшествует стадии формирования бактероидов — клеток неправильной формы: утолщенных, разветвленных, сферических, грушевидных и колбовидных (рис. 144). Термин «бактероиды» ввел в литературу Дж. Брунхорст в 1885 г., применив его к необычным по форме образованиям, значительно более крупным, чем палочковидные клетки бактерий, встречающимся в тканях клубеньков.
Бактероиды содержат большее количество волютиновых гранул и характеризуются более высоким содержанием гликогена и жира, чем палочковидные клетки. Бактероиды, выращенные в искусственных питательных средах и образовавшиеся в тканях клубенька, физиологически однотипны. Есть мнение, что бактероиды — это формы бактерий с незавершенным процессом деления. При незавершенном делении клеток клубеньковых бактерий возникают дихотомически ветвящиеся формы бактероидов. Количество бактероидов увеличивается при старении культуры; их появлению способствуют истощение питательной среды, накопление продуктов обмена, внесение в среду алкалоидов.
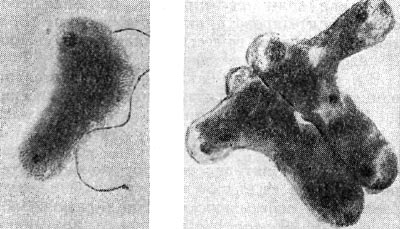
Рис. 144. Бактероиды клубеньковых бактерий клевера. Слева видна клетка со жгутиком. Увел. X 16 000.
В старых (двухмесячных) культурах клубеньковых бактерий с помощью электронного микроскопа можно выявить во многих клетках четко очерченные образования сферической формы (рис. 145) — артроспоры. Их количество в клетках варьирует от 1 до 5.
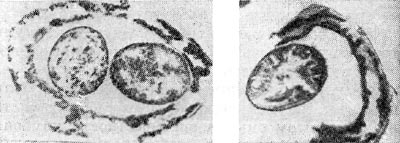
Рис. 145. Образование (слева) и выход (справа) артросиор из клеток клубеньковых бактерий клевера. Ультратонкие срезы. Увел. X 30 000.
На питательных средах клубеньковые бактерии различных видов бобовых растений растут с разной скоростью. К быстрорастущим относятся клубеньковые бактерии гороха, клевера, люцерны, кормовых бобов, вики, чечевицы, чины, донника, пажитника, фасоли, нута, лядвенца; к медленнорастущим — клубеньковые бактерии люпина, сои, арахиса, сераделлы, маша, вигны, эспарцета, дрока. Вполне сформировавшиеся колонии быстрорастущих культур можно получить на 3 — 4-е сутки инкубации, колонии медленнорастущих — на 7 - 8-е.
Для быстрорастущих клубеньковых бактерий характерно перитрихиальное расположение жгутиков, для медленнорастущих — монотрихиальное (табл. 42, 1—5).
Кроме жгутиков, у клеток клубеньковых бактерий при выращивании на жидких средах образуются нитевидные и четковидные выросты (табл. 42, 43). Длина их достигает 8 —10 мкм. Они обычно располагаются на поверхности клетки перитрихиально, содержится их от 4 до 10 и больше на одну клетку.
Колонии быстрорастущих клубеньковых бактерий имеют цвет топленого молока, часто полупрозрачные, слизистые, с ровными краями, умеренно выпуклые, со временем разрастаются на поверхности агаризованной среды. Колонии медленнорастущих бактерий более выпуклые, мелкие, сухие, плотные и, как правило, не разрастающиеся на поверхности среды. Слизь, вырабатываемая клубеньковыми бактериями, представляет собой комплексное соединение полисахаридного типа, в состав которого входят гексозы, пентозы и уроновые кислоты.
Клубеньковые бактерии — микроаэрофилы (развиваются при незначительных количествах кислорода в среде), предпочитающие, однако, аэробные условия.
В качестве источника углерода в питательных средах клубеньковые бактерии используют углеводы и органические кислоты, в качестве источника азота — разнообразные минеральные и органические азотсодержащие соединения. При культивировании на средах с высоким содержанием азотсодержащих веществ клубеньковые бактерии могут утратить способность проникать в растение и образовывать клубеньки. Поэтому обычно клубеньковые бактерии выращивают на растительных экстрактах (фасолевом, гороховом отваре) или почвенных вытяжках. Необходимый для развития фосфор клубеньковые бактерии могут получать из минеральных и органических фосфорсодержащих соединений; источником кальция, калия и других минеральных элементов могут служить минеральные соединения.
Для подавления посторонней сапрофитной микрофлоры при выделении клубеньковых бактерий из клубеньков или непосредственно из почвы рекомендуются питательные среды с добавлением кристаллического фиолетового, танина или антибиотиков.
Для развития большинства культур клубеньковых бактерий требуется оптимальная температура в пределах 24—26°. При 0° и 37 °С рост приостанавливается. Обычно культуры клубеньковых бактерий в условиях лаборатории хранят при пониженных температурах (2—4 °С).
Многие виды клубеньковых бактерий способны синтезировать витамины группы В, а также ростовые вещества типа гетероауксина (бета-индолилуксусная кислота).
Все клубеньковые бактерии приблизительно одинаково устойчивы к щелочной реакции среды (рН = 8,0), но неодинаково чувствительны к кислой.
Специфичность, вирулентность, конкурентоспособность и активность клубеньковых бактерий
Понятие специфичности клубеньковых бактерий — собирательное. Оно характеризует способность бактерий образовывать клубеньки у растений. Если говорить о клубеньковых бактериях вообще, то для них образование клубеньков только у группы бобовых растений уже само по себе специфично — они обладают избирательностью к бобовым растениям.
Однако если рассматривать отдельные культуры клубеньковых бактерий, то оказывается, что среди них есть такие, которые способны заражать лишь определенную, иногда большую, иногда меньшую, группу бобовых растений, и в этом смысле специфичность клубеньковых бактерий — это избирательная способность в отношении растения-хозяина. Специфичность клубеньковых бактерий может быть узкой (клубеньковые бактерии клевера заражают только группу клеверов — видовая специфичность, а клубеньковые бактерии люпина могут характеризоваться даже сортовой специфичностью — заражать только алкалоидные или безалкалоидные сорта люпина). При широкой специфичности клубеньковые бактерии гороха могут заражать растения гороха, чины, бобов, а клубеньковые бактерии чины и бобов могут заражать растения гороха, т. е. все они характеризуются способностью «перекрестного заражения». Специфичность клубеньковых бактерий лежит в основе их классификации.
Специфичность клубеньковых бактерий возникла в результате их длительного приспособления к одному растению или к группе их и генетической передачи этого свойства. В связи с этим различная приспособленность клубеньковых бактерий к растениям имеется и в пределах группы перекрестного заражения. Так, клубеньковые бактерии люцерны могут образовать клубеньки у донника. Но тем не менее они более приспособлены к люцерне, а бактерии донника — к доннику.
В процессе инфекции корневой системы бобовых растений клубеньковыми бактериями большое значение имеет вирулентность микроорганизмов. Если специфичностью определяется спектр действия бактерий, то вирулентность клубеньковых бактерий характеризует активность их действия в пределах данного спектра. Под вирулентностью подразумевается способность клубеньковых бактерий проникать в ткань корня, размножаться там и вызывать образование клубеньков.
Большую роль играет не только сама способность проникать в корни растения, но и скорость этого проникновения.
Для определения вирулентности штамма клубеньковых бактерий необходимо установить его способность вызывать образование клубеньков. Критерием вирулентности любого штамма может служить то минимальное количество бактерий, которое обеспечивает более энергичное инфицирование корней по сравнению с другими штаммами, завершающееся формированием клубеньков.

Рис. 146. Влияние разных по активности культур клубеньковых бактерий на развитие клевера. Справа — растение, зараженное неактивной культурой.
В почве в присутствии других штаммов не всегда более вирулентный штамм будет инфицировать растение первым. В этом случае следует учитывать его конкурентную способность, которая нередко маскирует свойство вирулентности в природных условиях.
Необходимо, чтобы вирулентные штаммы обладали и конкурентоспособностью, т. е. могли успешно конкурировать не только с представителями местной сапрофитной микрофлоры, но и с другими штаммами клубеньковых бактерий. Показателем конкурентоспособности штамма служит количество образованных им клубеньков в процентах от общего числа клубеньков на корнях растений.
Важным свойством клубеньковых бактерий является их активность (эффективность), т. е. способность в симбиозе с бобовыми растениями ассимилировать молекулярный азот и удовлетворять в нем потребности растения-хозяина. В зависимости от того, в какой степени клубеньковые бактерии способствуют повышению урожайности бобовых культур (рис. 146), их принято делить на активные (эффективные), малоактивные (малоэффективные) и неактивные (неэффективные).
Неактивный для одного растения-хозяина штамм бактерий в симбиозе с другим видом бобового растения может быть вполне эффективным. Поэтому при характеристике штамма с точки зрения его эффективности следует всегда указывать, в отношении какого вида растения-хозяина проявляется его действие.
Активность клубеньковых бактерий не является их постоянным свойством. Нередко в лабораторной практике наблюдается потеря активности у культур клубеньковых бактерий. При этом или теряется активность у всей культуры, или появляются отдельные клетки с малой активностью. Снижение степени активности клубеньковых бактерий происходит в присутствии некоторых антибиотиков, аминокислот. Одной из причин утраты активности клубеньковых бактерий может быть влияние фага. Пассированием, т. е. неоднократным проведением бактерий через растение-хозяина (адаптацией к определенному виду растения), можно получить эффективные штаммы из неэффективных.
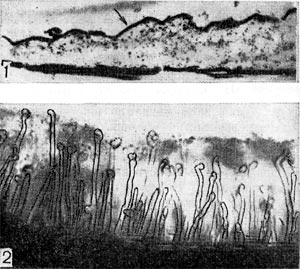
Рис. 147. Слой гранулированного вещества на поверхности корневого волоска (1) при электронно-микроскопическом исследовании (по П. Дарту, Ф. Мерсеру, увел. X 30 000) и слизистый зооглейный слой (2), в который погружены корневые волоски клевера, под световым микроскопом (увел. X 80).
Воздействие гамма-лучами дает возможность получать штаммы с усиленной эффективностью. Известны случаи возникновения высокоактивных радиомутантов клубеньковых бактерий люцерны из неактивного штамма. Применение ионизирующих излучений, оказывающих непосредственное влияние на изменение генетических особенностей клетки, по всей вероятности, может явиться перспективным приемом при селекции высокоактивных штаммов клубеньковых бактерий.
Инфицирование бобового растения клубеньковыми бактериями
Для обеспечения нормального процесса инфицирования корневой системы клубеньковыми бактериями необходимо наличие довольно большого количества жизнеспособных клеток бактерий в прикорневой зоне. Мнения исследователей в отношении количества клеток, необходимых для обеспечения процесса инокуляции, различны. Так, по данным американского ученого О. Аллена (1966), для инокуляции мелкосеменных растений требуется 500—1000 клеток, для инокуляции крупносеменных — не менее 70 000 клеток на 1 семя. По мнению австралийского исследователя Дж. Винцента (1966), в момент инокуляции на каждое семя должно приходиться по крайней мере несколько сотен жизнеспособных и активных клеток клубеньковых бактерий. Имеются данные, что в ткань корня могут внедряться и единичные клетки.
При развитии корневой системы бобового растения размножение клубеньковых бактерий на поверхности корня стимулируется выделениями корня. Продукты разрушения корневых чехликов и волосков играют также немаловажную роль в обеспечении клубеньковых бактерий подходящим субстратом.
В ризосфере бобового растения резко стимулируется развитие клубеньковых бактерий, для злаковых растений такого явления не наблюдается.
На поверхности корня имеется слой слизистого вещества (матрица), образующийся независимо от наличия в ризосфере бактерий. Этот слой хорошо виден при исследовании в светооптическом микроскопе (рис. 147). Клубеньковые бактерии после инокуляции обычно устремляются к этому слою и скапливаются в нем (рис. 148) вследствие стимуля-ционного эффекта корня, проявляющегося даже на расстоянии до 30 мм.
В этот период, предшествующий внедрению клубеньковых бактерий в ткань корня, бактерии в ризосфере чрезвычайно подвижны. В ранних работах, в которых для исследований использовался световой микроскоп, клубеньковым бактериям, находящимся в зоне ризосферы, было дано название швермеров (гони-дий или зооспор) — «роящихся». С помощью метода Фэреуса (1957)можно наблюдать образование чрезвычайно быстро движущихся колоний швермеров в области кончика корня и корневых волосков. Колонии швермеров существуют очень короткое время—менее суток.
О механизме проникновения клубеньковых бактерий в корень растения существует ряд гипотез. Наиболее интересные из них следующие. Авторы одной из гипотез утверждают, что клубеньковые бактерии проникают в корень через повреждения эпидер-мальной и коровой ткани (особенно в местах ответвления боковых корней). Эта гипотеза была выдвинута на основании исследований Бриля (1888), вызвавшего образование клубеньков у бобовых растений путем прокалывания корней иглой, погруженной предварительно в суспензию клубеньковых бактерий. Как частный случай такой путь внедрения вполне реален. Например, у арахиса клубеньки преимущественно располагаются в пазухах ответвлений корней, что наводит на мысль о проникновении клубеньковых бактерий в корень через разрывы при прорастании боковых корней.
Интересна и не лишена оснований гипотеза о проникновении клубеньковых бактерий в ткань корня через корневые волоски. Путь прохождения клубеньковых бактерий через корневые волоски признает большинство исследователей.
Очень убедительно предположение П. Дарта и Ф. Мерсера (1965) о том, что клубеньковые бактерии внедряются в корень в виде мелких (0,1—0,4 мкм) кокковидных клеток через промежутки (0,3—0,4 мкм) целлюлозной фибриллярной сети первичной оболочки корневых волосков. Электронно-микроскопические фотографии (рис. 149) поверхности корня, полученные методом реплик, и факт мельчания клеток клубеньковых бактерий в ризосфере бобовых растений подтверждают это положение.
Не исключено, что клубеньковые бактерии могут проникать в корень через эпидермальные клетки молодых верхушек корня. По мнению Пражмовского (1889), бактерии могут проникать в корень только через молодую клеточную оболочку (корневых волосков или эпи-дермальных клеток) и совершенно не способны преодолевать химически измененный или оп-робковевший слой коры. Этим можно объяснить, что клубеньки обычно развиваются на молодых участках главного корня и появляющихся боковых корнях.
В последнее время большую популярность получила ауксинная гипотеза. Авторы этой гипотезы считают, что клубеньковые бактерии проникают в корень благодаря стимуляции синтеза р-индолилуксусной кислоты (гете-роауксина) из триптофана, имеющегося всегда в корневых выделениях растений. С наличием гетероауксина связывается искривление корневых волосков, которое обычно наблюдается при инфицировании корневой системы клубеньковыми бактериями (рис. 150).
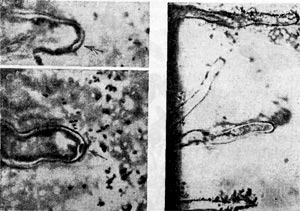
Рис. 148. Скопления клубеньковых бактерий вокруг корневых волосков. Стрелкой показано движение клеток клубеньковых бактерий к вершине корневого волоска клевера.
Источником бета-индолилуксусной кислоты в момент инфицирования растения, очевидно, служат не только растения, выделяющие через корневую систему триптофан, который многие виды бактерий, в том числе и клубеньковые, могут переводить в бета-индолилуксусную кислоту. Сами клубеньковые бактерии, а возможно, и другие виды почвенных микроорганизмов, живущие в зоне корня, также могут участвовать в синтезе гетероауксина.
Однако принимать безоговорочно ауксинную гипотезу нельзя. Действие гетероауксина неспецифично и вызывает искривление корневых волосков у разных видов растений, а не только бобовых. В то же время клубеньковые бактерии вызывают искривление корневых волосков лишь у бобовых растений, проявляя при этом довольно значительную избирательность. Если бы рассматриваемый эффект определялся только (З-индолилуксусной кислотой, то такой специфики не было бы. Кроме того, характер изменений корневых волосков под влиянием клубеньковых бактерий несколько иной, чем под влиянием гетероауксина.
Следует также отметить, что в отдельных случаях инфицированию подвергаются неискривленные корневые волоски. Наблюдения показывают, что у люцерны и гороха искривляются и закручиваются 60—70% корневых волосков, а у клевера — около 50%. У некоторых видов клевера эта реакция отмечается не более чем у 1/4 части заражаемых волосков. В реакции искривления, очевидно, имеет большое значение состояние корневого волоска. Растущие корневые волоски наиболее чувствительны к действию веществ, вырабатываемых бактериями.
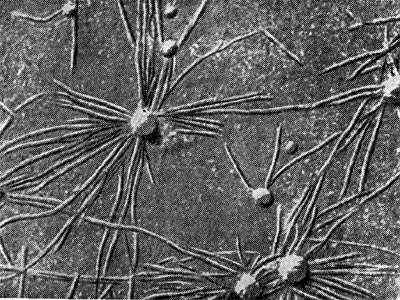
Рис. 149. Клетки клубеньковых бактерий на поверхности инфицированного корневого волоска бобового растения (по П. Дарту, Ф. Мерсеру).
Известно, что клубеньковые бактерии вызывают размягчение стенок корневых волосков. Однако ни целлюлазы, ни пектинолитических ферментов они не образуют. В связи с этим было высказано предположение, что клубеньковые бактерии проникают в корень благодаря выделению ими слизи полисахаридной природы, вызывающей синтез растениями фермента поли-галактуроназы. Этот фермент, разрушая пектиновые вещества, влияет на оболочку корневых волосков, делая ее более пластичной и проницаемой. В небольших количествах полигалактуроназа всегда присутствует в корневых волосках и, очевидно, вызывая частичное растворение соответствующих компонентов оболочки, позволяет клетке растягиваться.
Некоторые исследователи полагают, что клубеньковые бактерии проникают в корень благодаря бактериям-спутникам, продуцирующим пектинолитические ферменты. Эта гипотеза была выдвинута на основании следующих фактов. При микроскопировании корневых волосков многие исследователи отмечали наличие светлого пятна, около которого скапливаются клубеньковые бактерии. Это пятно, возможно, является признаком начала мацерации (разрушения) ткани протопектиназой по аналогии с таким же признаком, наблюдающимся у растений при многих бактериальных заболеваниях. Кроме того, установлено, что авирулентные культуры клубеньковых бактерий в присутствии бактерий, продуцирующих пектинолитические ферменты, становятся способными проникать в корень.
Следует отметить еще одну гипотезу, по которой клубеньковые бактерии попадают в корень при образовании пальцевидного впячивания поверхности корневого волоска. На электрон-нограмме среза корневого волоска, подтверждающей эту гипотезу (рис. 150, 5), виден изогнутый в виде ручки зонтика корневой волосок, в изгибе которого находится скопление клубеньковых бактерий. Клубеньковые бактерии как бы втягиваются (проглатываются) корневым волоском (подобно пиноцитозу).
Гипотеза инвагинации, по существу, не может быть отделена от ауксинной или ферментативной гипотезы, поскольку инвагинация происходит в результате воздействия либо ауксинного, либо ферментного фактора.
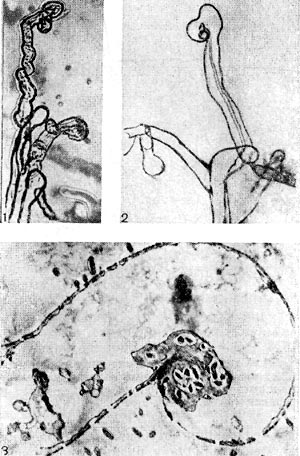
Рис. 150. Искривление корневых волосков бобовых растений в присутствии клубеньковых бактерий: 1,2 — увел, х 120; 3 — ультратонкий срез через корневой волосок. Увел. X 10 000 (по К. Сальману и Г. Фэреусу).
Процесс внедрения клубеньковых бактерий в ткань корня одинаков у всех видов бобовых растений и состоит из двух фаз. В первую фазу происходит инфицирование корневых волосков. Во вторую фазу интенсивно идет процесс образования клубеньков. Продолжительность фаз различна у разных видов растений: у Trifolium fragiferum первая фаза продолжается 6 дней, у Trifolium nigrescens — 3 дня. В некоторых случаях очень трудно обнаружить границы между фазами. Наиболее интенсивное внедрение клубеньковых бактерий в корневые волоски происходит на ранних этапах развития растения. Вторая фаза заканчивается в период массового образования клубеньков. Нередко внедрение клубеньковых бактерий в корневые волоски продолжается уже и после того, как клубеньки сформировались на корнях. Эта так называемая избыточная или дополнительная инфекция происходит потому, что инфицирование волосков не прекращается длительное время. В более поздние сроки заражения клубеньки обычно размещаются ниже по корню.
Тип развития, структура и плотность корневых волосков не влияют на скорость внедрения клубеньковых бактерий. Места образования клубеньков не всегда связаны с местами расположения инфицированных волосков.
Проникнув в корень (через корневой волосок, эпидермальную клетку, места повреждений корня), клубеньковые бактерии далее перемещаются в ткани корня растения. Наиболее легко бактерии проходят через межклеточные пространства.
Внедриться в ткань корня может или одиночная клетка, или группа клеток бактерий. Если внедрилась отдельная клетка, она и в дальнейшем может перемещаться по ткани как одиночка. Путь инфицирования корня одиночными клетками свойствен растениям люпина.
Однако в большинстве случаев внедрившаяся клетка, активно размножаясь, образует так называемые инфекционные нити (или инфекционные тджи) и уже в виде таких нитей перемещается в ткани растения.
Термин «инфекционная нить» возник на основе изучения процесса инфицирования в световом микроскопе. Начиная с работ Бейеринка, инфекционная нить стала рассматриваться как слизистая гифообразная масса с заключенными в нее размножающимися бактериями.
По существу, инфекционная нить — это колония размножившихся бактерий. Началом ее служит то место, куда проникла отдельная клетка или группа клеток. Не исключено, что колония бактерий (а следовательно, и будущая инфекционная нить) начинает формироваться еще на поверхности корня до момента внедрения бактерий в корень.
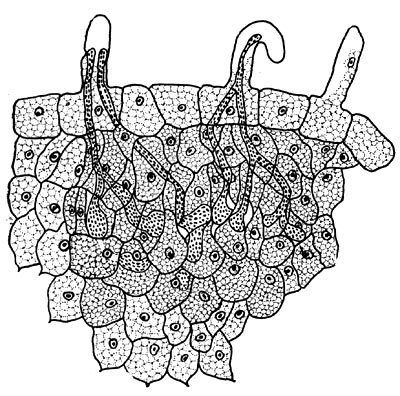
Рис. 151. Схема возникновения инфекционных нитей. В неискривленном корневом волоске видны две инфекционные нити, в искривленном — одна разветвляющаяся (по Ф. Бибердорфу).
Количество инфицированных корневых волосков значительно различается у отдельных растений. Обычно инфекционные нити появляются в деформированных, искривленных корневых волосках. Однако есть указания, что и в прямых волосках иногда обнаруживаются подобные нити. Чаще в корневых волосках наблюдается одна разветвляющаяся нить, реже две. В некоторых случаях в одном корневом волоске имеется несколько нитей или же в нескольких имеются общие нити заражения, дающие начало одному клубеньку (рис. 151).
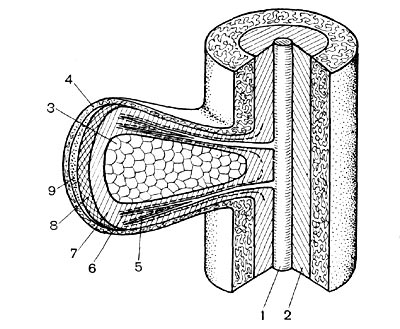
Рис. 152. Схема, показывающая связь корня с клубеньком: 1 — сосудистая ткань корня; 2 — корневая эндодерма; 3 — бактёроидная зона клубенька; 4 — кора клубенька; 5 — сосудистые пучки клубенька; б — эндодерма сосудистых пучков; 7 — клубеньковая эндодерма; 8 — меристема; 9 — верхушечная меристема.
Процент инфицированных корневых волосков в общем количестве деформированных необъяснимо низок. Он обычно колеблется от 0,6 до 3,2, изредка достигая 8,0. Доля удачных инфекций еще ниже, поскольку среди инфекционных нитей имеется много (до 80%) так называемых абортивных нитей, прекративших свое развитие. Скорость продвижения нормально развивающихся инфекционных нитей в растении — 5—8 мкм в час. При такой скорости путь через корневой волосок длиной 100—200 мкм инфекционная нить может пройти в течение одних суток.
Морфолого-анатомическая характеристика клубеньков в их онтогенезе
По способу образования клубеньки бобовых растений подразделяются на два типа: 1-й тип — клубеньки возникают при делении клеток перицикла (кор-неродного слоя), обычно расположенных против протоксилемы (первых по времени образования сосудов) — эндогенный тип образования клубеньков; 2-й тип — клубеньки происходят из коры корня в результате внедрения возбудителя в паренхимные клетки коры и эндодермы (внутреннего слоя первичной коры) — экзогенный тип образования клубеньков.
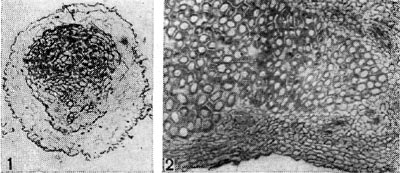
Рис. 153. Срезы через клубеньковую ткань бобовых растений: 1 — поперечный срез через клубенек гороха. Начало дифференциации сосудистой ткани в клубеньке (по Г. Бонду); г — продольный срез через клубенек чины. Увел. X 90.
В природе преобладает последний тип. Ткани центрального цилиндра корня принимают участие только в образовании сосудистой системы клубеньков как эндогенного, так и экзогенного типа.
Несмотря на различные взгляды на природу возникновения клубеньков экзо- и эндотипов, процесс развития их в основном одинаков. Однако ни тот, ни другой тип образования клубеньков ни в коем случае не следует отождествлять с процессом образования боковых корней, несмотря на то что существуют и отдельные черты сходства в их заложении. Так, формирование клубеньков и боковых корней происходит одновременно и к тому же в одной и той же зоне корня.
В то же время ряд особенностей развития боковых корней и клубеньков подчеркивает глубокие различия в типе их формирования. Боковые корни возникают в перицикле. С первых же моментов развития они связаны с центральным цилиндром главного корня, от которого ответвляются центральные цилиндры боковых корней,и возникают они всегда против луча первичной древесины. Формирование клубенька, в отличие от бокового корня, возможно в любом месте. В самом начале формирования клубеньковой ткани сосудистой связи с центральным цилиндром корня нет, она возникает позднее. Сосуды обычно формируются по периферии клубенька. Они связаны с сосудами корня через зону трахеид и имеют собственную эндодерму (рис. 152).
Различие в характере возникновения клубеньков и боковых корней особенно четко наблюдается у сераделлы, поскольку коровая ткань главного корня этого растения — место возникновения первых клубеньков — состоит из относительно небольшого слоя клеток и клубеньки становятся видимыми очень быстро после инфицирования корня бактериями. Они образуют сначала выступы уплощенной формы на корне, что позволяет отличить их от конических выступов боковых корней. Клубеньки отличаются от боковых корней и рядом анатомических признаков: отсутствием центрального цилиндра, корневых чехликов и эпидермиса, наличием значительного слоя коры, покрывающей клубенек.
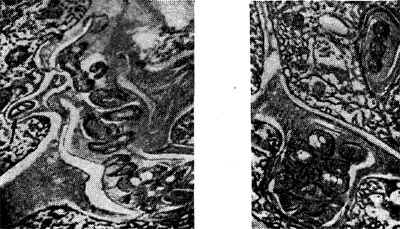
Рис. 154. Интерцеллюлярные инфекционные нити в виде кармана (справа) и факела (слева) с клубеньковыми бактериями. Стрелкой показана клетка бактерий, приготовившаяся к выходу в цитоплазму растительной клетки. Увел. X 20 000.
Формирование клубеньков (рис. 153, 1, 2) бобовых растений происходит в период, когда корень имеет еще первичную структуру. Оно начинается с деления коровых клеток, расположенных на расстоянии 2—3 слоев от концов инфекционных нитей. Слои коры, пронизанные инфекционными нитями, остаются без изменения. В то же время у сераделлы деление коровых клеток возникает непосредственно под инфицированным корневым волоском, а у гороха деление клеток отмечается только в предпоследнем слое коры.
Деление с образованием радиальной структуры ткани продолжается до внутренних коровых клеток. Происходит оно без определенного направления, беспорядочно, и в результате этого возникает меристема (система образовательных тканей) клубенька, состоящая из мелких зернистых клеток.
Разделившиеся клетки коры изменяются: ядра округляются и увеличиваются в размерах, особенно увеличиваются ядрышки. После митоза ядра расходятся и, не принимая первоначальной формы, вновь начинают делиться.
Возникает вторичная меристема. Вскоре в эндодерме и перицикле появляются признаки начинающегося деления, которое в прежних внешних клетках происходит главным образом тангентальными перегородками. Это деление распространяется, наконец, на общий меристе-матический комплекс, мелкие клетки которого вытягиваются, вакуоли исчезают, ядро заполняет большую часть клетки. Образуется так называемый первичный клубенек, в плазме клеток которого клубеньковые бактерии отсутствуют, поскольку они на данной стадии еще находятся внутри инфекционных нитей. В то время как образуется первичный клубенек, инфекционные нити многократно разветвляются и могут проходить или между клетками — интерцеллюлярно (рис. 154), или сквозь клетки — интрацеллюлярно — и вносить бактерии (рис. 155).
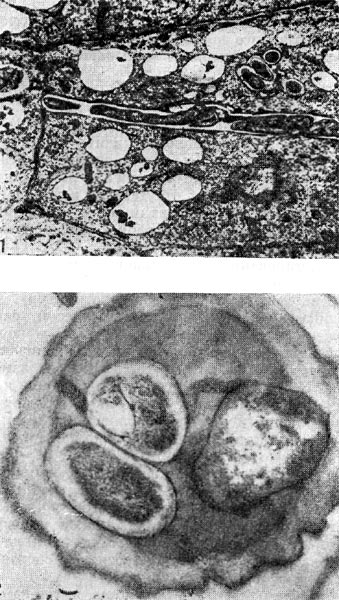
Рис. 155. Интрацеллюлярные инфекционные нити с клубеньковыми бактериями: 1 — продольный разрез (по Д. Гудчильду и Ф. Бергерсену), 2 — поперечный срез. Увел, х 35 000.
Межклеточные инфекционные нити вследствие активного размножения в них клубеньковых бактерий нередко приобретают причудливую форму — формируются в виде карманов (дивертикулов) или факелов (см. рис. 154).
Процесс передвижения инфекционных нитей из клетки в клетку не совсем ясен. По-видимому, инфекционные нити, как полагает канадский микробиолог Д. Джордан (19(53), блуждают в виде голых слизистых тяжей в межклеточных промежутках растительной ткани до тех пор, пока вследствие каких-то еще необъяснимых причин не начинают инвагинировать в цитоплазму примыкающих клеток.
В некоторых случаях инвагинация инфекционной нити происходит в одну, в некоторых случаях — в каждую соседнюю клетку. По этим инвагинированным трубчатым полостям (дивертикулам) перетекает заключенное в слизь содержимое нити. Наиболее активный рост инфекционных нитей происходит обычно вблизи ядра растительной клетки. Проникновение нити сопровождается перемещением ядра, которое продвигается к месту инфекции, увеличивается, меняет форму и дегенерирует. Подобная картина наблюдается при грибной инфекции, когда ядро нередко устремляется навстречу внедрившимся гифам, притягивается к повреждению как к месту наибольшей физиологической активности, вплотную придвигается к нити, разбухает и разрушается. По-видимому, это характерно для ответной реакции растения на инфекцию.
У однолетних растений инфекционные нити возникают обычно в первый период инфицирования корня, у многолетних — в течение длительного периода развития.
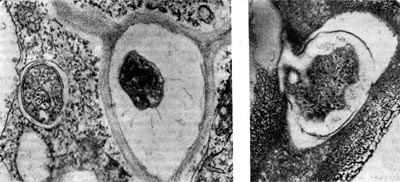
Рис. 156. Клетки клубеньковых бактерий в межклеточном пространстве (слева, по Д. Джордану) и в момент входа из межклеточного пространства в клетку растения (справа). Увел. X 60 000.
Бактерии могут высвобождаться из инфекционной нити в разное время и разными способами. Выход бактерий, как правило, весьма длительный процесс, особенно у многолетних растений. Обычно выход бактерий из инфекционной нити в цитоплазму растения-хозяина связывают с внутренним давлением, возникающим вследствие интенсивного размножения бактерий в нити и экскреции ими слизи. Иногда бактерии выскальзывают из нити группами, окруженными слизью инфекционной нити. в виде везикул (пузыревидных образований) (рис. 157). Поскольку везикулы не имеют оболочек, выход из них бактерий очень прост. В клетки растений клубеньковые бактерии могут попадать и поодиночке из межклеточных пространств (рис. 156).
Клубеньковые бактерии, вышедшие из инфекционной нити, продолжают размножаться в ткани хозяина. Размножение их в этот период происходит делением перетяжкой (рис. 158). Основная масса бактерий размножается в цитоплазме клетки, а не в инфекционной нити. Зараженные клетки дают начало будущей бактероидной ткани.
Наполняющиеся быстро размножающимися клетками клубеньковых бактерий растительные клетки начинают усиленно делиться. В момент митотического деления зараженных клеток клубеньковые бактерии могут скапливаться на двух противоположных полюсах материнской клетки и пассивно попадать в дочерние клетки. Каждая из незараженных клеток находится при этом под сильным стимулирующим воздействием клубеньковых бактерий и вследствие этого также делится. Благодаря такому энергично протекающему митотическому делению меристематических клеток осуществляется распространение клубеньковых бактерий в ткани клубенька и увеличение объема бактероидной области.
Инфицированная ткань, состоящая из плотно лежащих и активно делящихся клеток, имеет сначала форму усеченного конуса. В дальнейшем вследствие постепенного роста этого конуса и одновременного деления и развития меристематических клеток ткань клубенька разрастается, утрачивая конусовидность.
Таким образом, клубенек увеличивается сначала в результате радиального и тангенталь-ного деления коровых клеток, а затем за счет увеличения их размера и одновременного деления. После того как растительные клетки полностью заполнятся бактериями, митоз прекращается. Однако клетки продолжают увеличиваться в размере и часто сильно вытягиваются. Размер их в несколько раз больше, чем у неинфицированных растительных клеток, которые расположены между ними в бактероидной зоне клубенька.
Связь молодого клубенька с корнем бобового растения осуществляется благодаря сосудисто-волокнистым пучкам. Впервые сосудисто-волокнистые пучки наблюдал М. С. Воронин (1866). Время возникновения сосудистой системы в клубеньках различных видов бобовых растений различно. Так, у клубеньков сои начало развития сосудистых пучков совпадает с моментом проникновения клубеньковых бактерий в два слоя коровой паренхимы. С ростом клубенька проводящая система разрастается, разветвляется и окружает бактероидную область.
Параллельно с процессом дифференциации сосудистой системы идет формирование клубеньковой эндодермы из внешнего слоя первичного клубенька. Затем клубенек округляется, его периферийный клеточный слой окружается клубеньковой корой.
Корневой эпидермис разрывается, а клубенек продолжает развиваться и увеличиваться в размерах.
С помощью светового микроскопа на продольных срезах зрелых клубеньков обычно четко выделяются 4 характерные зоны тканевой дифференциации: кора, меристема, бакте-роидная зона и сосудистая система. Все ткани клубенька дифференцируются в акропетальной последовательности, так как новые клетки закладываются меристемой.
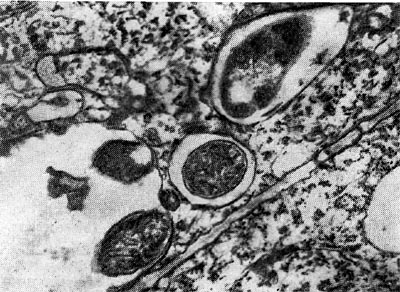
Рис. 157. Выход клубеньковых бактерий в ткань корня из везикулоподобных образований инфекционных нитей (по Гудчильду и Бергерсену).
Клубеньковая кора — оболочка клубенька, выполняющая защитную функцию. Кора состоит из нескольких рядов незараженных паренхимных клеток, величина и особенности которых различны у разных бобовых культур. Чаще всего клетки коры имеют вытянутую форму и крупнее по сравнению с другими клетками клубенька.
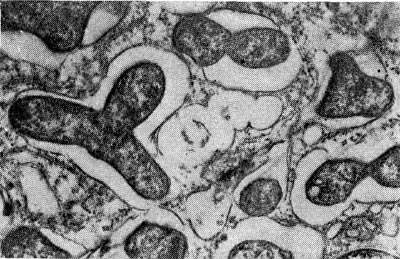
Рис. 158. Размножение клубеньковых бактерий в клубеньке чины. Увел. X 28 000.
В коре клубеньков многолетних деревянистых видов часто встречаются клетки с опробковевшими оболочками, содержащие смолы, танин, дубильные вещества.
Клубеньковая меристема расположена под клетками коры и представляет собой зону интенсивно делящихся также незараженных клеток. Для меристемы клубенька характерны плотно расположенные, без межклетников, мелкие тонкостенные клетки неправильной формы. Клетки меристемы клубенька подобны клеткам других типов меристематической ткани (верхушки корня, верхушки стебля). Клетки клубеньковой меристемы содержат плотную, тонко гранулированную цитоплазму с рибосомами, телами Гольджи, протопластидами, митохондриями и другими структурами. Встречаются небольшие вакуоли. В центре цитоплазмы расположено крупное ядро с ядерной мембраной, порами и четко выраженным ядрышком. Функции меристематических клеток заключаются в формировании клеток клубеньковой коры, бактероидной области и сосудистой системы. В зависимости от расположения меристемы клубеньки имеют разнообразную форму: шаровидную (горох, фасоль, сераделла, арахис) или цилиндрическую (люцерна, вика, чина, акация, клевер) (рис. 159). Меристема, расположенная отдельными участками по периферии клубенька, приводит к образованию муфтооб-разных клубеньков у люпина.
Клубеньковая меристема функционирует долго, даже во время некроза клубеньков, когда они уже наполнены лизирующейся бактероидной массой и разрушенными растительными клетками.
Бактероидная зона клубенька занимает его центральную часть и составляет от 16 до 50% от общей сухой массы клубеньков. В первый период формирования клубенька она, по существу, является бактериальной зоной (рис. 160), так как заполнена клетками бактерий, находящихся в бактериальной, а не бактероидной стадии развития. Тем не менее принято, когда идет речь о зоне клубеньковой ткани, содержащей бактерии, называть ее бактероидной.
Бактероидная область клубенька состоит в основном из инфицированных клубеньковыми бактериями клеток и частично из смежных с ними неинфицированных клеток, заполненных пигментами, дубильными веществами, а к осени — крахмалом.
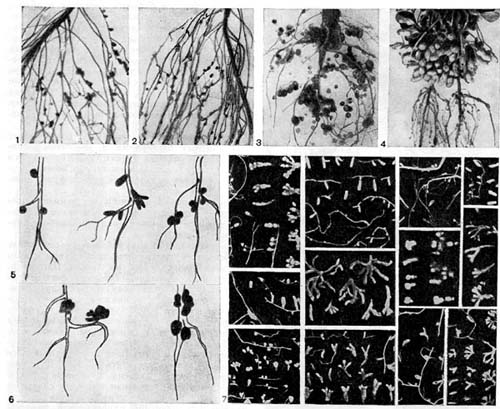
Ряс. 159. Форма клубеньков у бобовых растений: 1, 2 — гороха ; 3, 6 (справа) — люпина; 4 — арахиса (по Е. Швингхамеру); 5 — чины, клевера, вики, 6 (слева) — люцерны (по Я. Дэйту); 7 — разных видов дикорастущих бобовых растений (по А.Р. Вернеру, Н.Я. Гордиенко).
В клубеньках, образованных эффективными штаммами клубеньковых бактерий, средний относительный объем бактероидной зоны выше, чем в клубеньках, сформировавшихся при внедрении неэффективных штаммов.
В некоторых случаях объем бактероидной области достигает максимума в ранний период жизни клубенька и впоследствии остается относительно постоянным. Бактероидная зона пронизана густой сетью инфекционных нитей, а по периферии окружена сосудисто-волокнистыми пучками.
Форма бактероидов в клубеньках разных видов бобовых культур может быть разнообразной (табл. 44). Так, у вики, чины и гороха они двухветвистые или вильчатые. Для клевера и эспарцета преобладающая форма бактероидов шаровидная, грушеобразная, вздутая, яйцевидная, для нута округлая. Форма бактероидов фасоли, сераделлы, лядвенца и люпина практически палочковидная.
Бактероиды заполняют большую часть растительной клетки, за исключением центральной зоны ядра и вакуолей. Так, процент бактероидов в бактероидной зоне окрашенного в розовый цвет клубенька составляет 94,2 к общему числу клубеньковых бактерий. Клетки бактероидов в 3—5 раз больше клеток бактерий (рис. 161,1, 2).
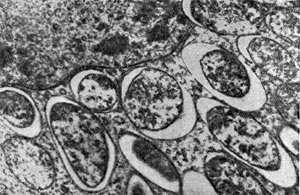
Рис. 160. Клетки клубеньковых бактерий вокруг ядра растительной клетки клубеньков вики. Увел. X 20 000.
Бактероиды клубеньковых бактерий представляют особый интерес в связи с тем, что они являются чуть ли не единственными обитателями клубеньков бобовых растений в период интенсивного связывания ими атмосферного азота. Отдельные исследователи считают бактероиды патологическими дегенеративными формами и не связывают процесс азотфиксации с бактероидной формой клубеньковых бактерий. Большинство исследователей находят, что бактероиды являются самыми жизнеспособными и активными формами клубеньковых бактерий и что фиксация азота атмосферы бобовыми растениями осуществляется только при их участии (рис. 162).
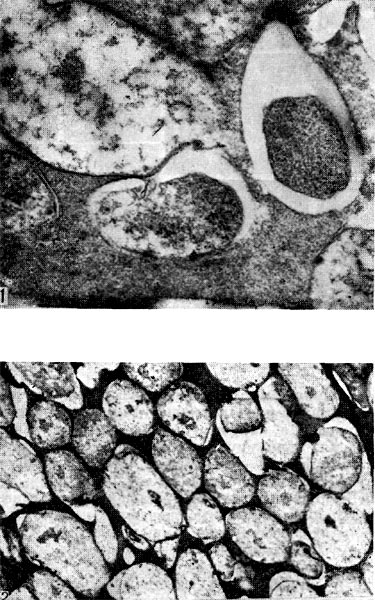
Рис. 161. Переход бактерий в бактероиды (1 — увел. Х25 000) и сформировавшаяся бактероидная ткань (2 — увел. X15 000) в клубеньках люцерны.
Сосудистая система клубенька обеспечивает связь между бактериями и растением-хозяином. По сосудистым пучкам транспортируются питательные вещества и продукты обмена. Сосудистая система развивается рано и функционирует длительное время.
Вполне сформировавшиеся сосуды имеют определенное строение: состоят из трахеид ксилемы, волокон флоэмы, ситовидных трубок и сопровождающих клеток.
В зависимости от вида бобовых культур связь клубецька осуществляется посредством одного или нескольких сосудистых пучков. Например, у гороха в основании клубенька имеется два дифференцированных сосудистых узла. Каждый из них обычно дважды дихотомически разветвляется, и в результате сквозь клубенек от места второго дихотомического разветвления проходит 8 пучков. Многие растения имеют лишь один пучок, в то же время у одного клубенька Sesbania grandiflora в возрасте одного года их удалось насчитать до 126. Довольно часто сосудистая система клубенька отделяется с внешней стороны от его коры слоем частично или полностью опробковевших клеток, получивших название клубеньковой эндодермы, соединенных с эндодермой корня. Клубеньковая эндодерма представляет собой внешний слой неинфицированной коровой паренхимы, расположенной между клубеньковой тканью и корневой корой.
У большей части видов растений клубеньки образуются по описанному типу. Следовательно, образование клубеньков — результат сложных явлений, начинающихся вне корня. Вслед за начальными фазами инфекции индуцируется образование клубенька, затем происходит распространение бактерий в зоне клубеньковой ткани и фиксация азота.
Все стадии развития клубеньковых бактерий, по данным чешского микробиолога В. Каша (1928), можно проследить на срезах клубеньков. Так, в верхней части клубенька, например, люцерны содержатся в основном мелкие делящиеся палочковидные клетки, в небольшом количестве молодые бактероиды, число которых возрастает постепенно по мере развития клубенька. В средней, окрашенной в розовый цвет части клубенька обнаруживаются преимущественно бактероидные клетки и реже мелкие палочковидные. В основании клубенька на ранних стадиях вегетации растения-хозяина бактероиды такие же, как и в средней его части, а к концу вегетации более раздутые и раньше дегенерирующие.
Сроки появления первых видимых клубеньков на корнях различных видов бобовых растений различны (М. В. Федоров, 1952). Появление их у большинства бобовых культур чаще всего происходит во время развития первых настоящих листьев. Так, образование первых клубеньков люцерны посевной наблюдается между 4-м и 5-м днями после прорастания, а на 7 — 8-й день этот процесс происходит у всех растений. Клубеньки у люцерны серповидной появляются через 10 дней.
В период функционирования клубеньки обычно плотные. Клубеньки, образованные активными культурами бактерий, в молодом возрасте имеют беловатую окраску. К моменту проявления оптимальной активности они становятся розовыми. Клубеньки, возникшие при инфекции неактивными культурами бактерий, зеленоватого тона. Нередко их структура практически не отличается от структуры клубеньков, образованных при участии активных штаммов клубеньковых бактерий, но они преждевременно разрушаются.
В некоторых случаях строение клубеньков, образуемых неактивными бактериями, отклоняется от нормы. Это выражается в дезорганизации клубеньковой ткани, утрачивающей обычно четко выраженную зональную дифференциацию.
Розовая окраска определяется наличием в клубеньках пигмента, по химическому составу близкого гемоглобину крови. В связи с этим пигмент называется леггемоглобином (легоглобином) — гемоглобином Leguminosae. Легоглобин содержится лишь в тех клетках клубеньков, в которых имеются бактероиды. Он локализован в пространстве между бактероидами и окружающей их мембраной.
Количество его колеблется от 1 до 3 мг на 1 г клубенька, в зависимости от вида бобового растения.
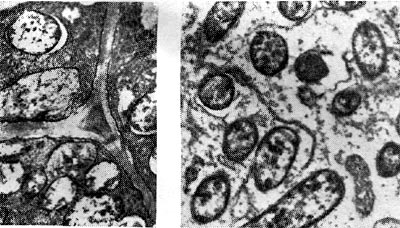
Рис. 162. Бактериодная ткань в период активного функционирования клубеньков клевера (слева увел. X 10 000) и вики посевной (справа — увел. X 6000).
У однолетних бобовых растений к концу вегетационного периода, когда заканчивается процесс азотфиксации, красный пигмент переходит в зеленый. Изменение цвета начинается у основания клубенька, позднее зеленеет его вершина. У многолетних бобовых растений позеленения клубеньков не происходит или оно наблюдается только у основания клубенька. У разных видов бобовых растений переход красного пигмента в зеленый происходит с разной степенью интенсивности и разной скоростью.
Клубеньки однолетних растений функционируют сравнительно недолго. У большинства бобовых культур некроз клубенька начинается в период цветения растения-хозяина и протекает обычно в направлении от центра к периферии клубенька. Один из первых признаков разрушения — образование слоя клеток с мощными стенками у основания клубенька. Этот слой клеток, расположенный перпендикулярно к главному сосуду корня, разъединяет его с клубеньком и задерживает обмен питательными веществами между растением-хозяином и тканями клубенька.
В клетках дегенерирующей ткани клубенька появляются многочисленные вакуоли, ядра теряют способность окрашиваться, часть клеток клубеньковых бактерий лизируется, часть мигрирует в окружающую среду в виде мелких кокковидных клеток-артроспор.
Процесс формирования артроспор в ткани лизирующегося клубенька показан на рисунках 163—165. Прекращают функционировать в этот период и инфекционные нити (рис. 166). Клетки хозяина утрачивают тургор и сжимаются теми соседними клетками, которым он еще свойствен.
Старые клубеньки темные, дряблые, мягкие. При надрезе из них выступает водянистая слизь. Процессу разрушения клубенька, начинающегося с опробковения клеток сосудистой системы, способствуют понижение фотосинтетической активности растения, сухость или чрезмерная влажность среды.
В разрушенном, ослизненном клубеньке обнаруживаются часто простейшие, грибы, бациллы и мелкие палочковидные клубеньковые бактерии.
Состояние растения-хозяина оказывает влияние на длительность функционирования клубенька. Так, по данным Ф. Ф. Юхимчука (1957), кастрируя или удаляя цветы люпина, можно продлить период его вегетации и вместе с тем время активной деятельности клубеньковых бактерий.
Клубеньки многолетних растений, в отличие от клубеньков однолетних, могут функционировать в течение многих лет. Так, например, карагана имеет многолетние клубеньки, в которых процесс старения клеток идет одновременно с образованием новых. У вистерии (глицинии китайской) также функционируют многолетние клубеньки, образуя на корнях хозяина шаровидные вздутия. К концу вегетационного периода бактероидная ткань многолетних клубеньков деградирует, но весь клубенек не отмирает. На следующий год он вновь начинает функционировать.
Факторы, определяющие симбиотические взаимоотношения клубеньковых бактерий с бобовыми растениями
Для симбиоза, обеспечивающего хорошее развитие растений, необходим определенный комплекс условий среды. Если условия окружающей среды будут неблагоприятными, то, даже несмотря на высокую вирулентность, конкурентную способность и активность микросимбионта, эффективность симбиоза будет низкой.
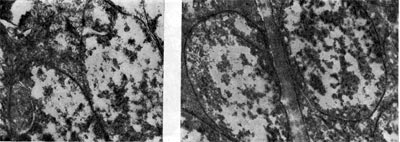
Рис. 163. Начальный период формирования артроспор в бактероидах клевера. Увел. X 30 000.
Для развития клубеньков оптимальная влажность 60—70% от полной влагоемкости почвы. Минимальная влажность почвы, при которой еще возможно развитие клубеньковых бактерий в почве, приблизительно равна 16% от полной влагоемкости. При влажности ниже этого предела клубеньковые бактерии обычно уже не размножаются, но тем не менее они не погибают и могут длительное время сохраняться в неактивном состоянии. Недостаток влаги приводит и к отмиранию уже сформировавшихся клубеньков.
Нередко в районах с недостаточным увлажнением многие бобовые растения развиваются, не образуя клубеньков.
Поскольку размножение клубеньковых бактерий в отсутствие влаги не происходит, в случае засушливой весны инокулированные (искусственно зараженные) семена необходимо вносить глубже в почву. Например, в Австралии семена с нанесенными на них клубеньковыми бактериями глубоко заделывают в почву. Интересно, что клубеньковые бактерии почв засушливого климата более стойко переносят засуху, чем бактерии почв влажного климата. В этом проявляется их экологическая приспособленность.
Избыточная влажность, как и ее недостаток, также неблагоприятна для симбиоза — из-за снижения степени аэрации в зоне корней ухудшается снабжение корневой системы растения кислородом. Недостаточная аэрация отрицательно влияет и на живущие в почве клубеньковые бактерии, которые, как известно, лучше размножаются при доступе кислорода. Тем не менее высокая аэрация в зоне корней приводит к тому, что кислород начинают связывать восстановители молекулярного азота, снижая степень азотфиксации клубеньков.
Важную роль во взаимоотношениях клубеньковых бактерий и бобовых растений играет температурный фактор. Температурные характеристики разных видов бобовых растений различны. Также и разные штаммы клубеньковых бактерий имеют свои определенные температурные оптимумы развития и активной фиксации азота. Следует отметить, что оптимальные температуры развития бобовых растений, образования клубеньков и азотфиксации не совпадают. Так, в природных условиях образование клубеньков может наблюдаться при температурах несколько выше О °С, азот-фиксация при таких условиях практически не происходит. Возможно, лишь арктические симбиозирующие бобовые растения связывают азот при очень низких температурах. Обычно же этот процесс происходит лишь при 10 °С и выше. Максимальная азотфиксация ряда бобовых растений наблюдается при 20—25 °С. Температура выше 30 °С отрицательно влияет на процесс азотонакопления.
Экологическая адаптация к температурному фактору у клубеньковых бактерий значительно меньше, чем у многих типичных сапрофитных форм. По мнению Е.Н. Мишустина (1970), это объясняется тем, что естественной средой обитания клубеньковых бактерий являются ткани растений, где температурные условия регулируются растением-хозяином.
Большое влияние на жизнедеятельность клубеньковых бактерий и образование клубеньков оказывает реакция почвы. Для разных видов и даже штаммов клубеньковых бактерий значение рН среды обитания несколько различно. Так, например, клубеньковые бактерии клевера более устойчивы к низким значениям р.Н, чем клубеньковые бактерии люцерны. Очевидно, здесь также сказывается адаптация мпкро-ерганизмов к среде обитания. Клевер растет на более кислых почвах, чем люцерна. Реакция почвы как экологический фактор оказывает влияние на активность и вирулентность клубеньковых бактерий. Наиболее активные штаммы, как правило, легче выделить из почв с нейтральными значениями рН. В кислых почвах чаще встречаются неактивные и слабовирулентные штаммы. Кислая среда (рН 4,0 — 4,5) оказывает непосредственное влияние и на растения, в частности нарушая синтетические процессы обмена веществ растений и нормальное развитие корневых волосков. В кислой среде у инокулированных растений резко сокращается срок функционирования бакте-роидной ткани, что ведет к снижению степени азотфиксации.
В кислых почвах, как отмечает А. В. Петербургский, в почвенный раствор переходят соли алюминия и марганца, неблагоприятно действующие на развитие корневой системы растений и процесс азотоусвоения, а также снижается содержание усвояемых форм фосфора, кальция, молибдена и углекислоты. Неблагоприятную реакцию почвы лучше всего устраняет известкование.
Размеры симбиотической азотфиксации определяются в значительной степени условиями питания растения-хозяина, а не клубеньковых бактерий. Клубеньковые бактерии как эндотрофные симбионты растений зависят в основном от растения при получении углеродсодер-жащих веществ и минеральных элементов питания.
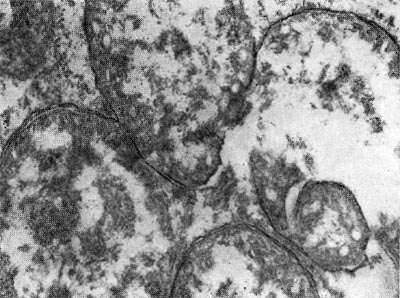
Рис. 164. Бактероид со сформировавшейся артроспорой клубеньковой бактерии клевера. Увел. X 35 000.
Для клубеньковых бактерий ткань хозяина представляет такую питательную среду, которая может удовлетворить даже самый требовательный штамм вследствие содержания в ткани всех типов питательных веществ. Тем не менее после внедрения клубеньковых бактерий в ткань растения-хозяина их развитие определяется не только внутренними процессами, но и в значительной степени зависит от действия внешних факторов, оказывающих влияние на весь ход инфекционного процесса. Содержание или отсутствие того или иного питательного вещества в окружающей среде может быть определяющим моментом для проявления симбиотической азотфиксации.
Степень обеспеченности бобовых растений доступными формами минеральных соединений азота определяет эффективность симбиоза. На основании многочисленных лабораторных и вегетационных опытов известно, что чем больше азотсодержащих соединений в окружающей среде, тем с большим трудом внедряются бактерии в корень.
Сельскохозяйственная практика требует однозначно решить задачу — целесообразнее удобрять бобовые культуры азотом или же правы те исследователи, которые утверждают, что минеральный азот подавляет симбиотическую азотфиксацию бобовых культур и поэтому экономически выгоднее такие растения азотом не удобрять. На кафедре агрономической и биологической химии Московской сельскохозяйственной академии им. К. А. Тимирязева были проведены опыты, результаты которых дали возможность получить картину поведения симбионтов в условиях вегетационных и полевых опытов при обеспеченности растений разными дозами азота в среде. Установлено, что повышение содержания растворимых азотсодержащих соединений в среде в полевых условиях при оптимальных условиях произрастания растений не препятствует их симбиозу с клубеньковыми бактериями. Снижение доли атмосферного азота, усваиваемого растениями при повышенной обеспеченности минеральным азотом, имеет только относительный характер. Абсолютное количество азота, усвоенного бактериями из атмосферы, практически не снижается, даже нередко увеличивается по сравнению с растениями, выращивающимися в присутствии клубеньковых бактерий, но без внесения в почву азота.
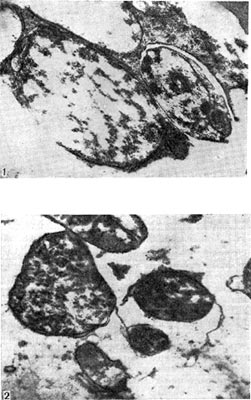
Рис. 165. Миграция артроспор в окружающую среду из клубеньков: 1 — клевера (увел. X 17 000), 2 — люцерны (увел. X 23 000).
Большое значение в активации усвоения азота бобовыми растениями имеет фосфорное питание. При низком содержании фосфора в среде проникновение бактерий в корень происходит, но клубеньки при этом не образуются. Бобовым растениям присущи некоторые особенности в обмене фосфорсодержащих соединений. Семена бобовых отличаются повышенным содержанием фосфора. Запасной фосфор при прорастании семян используется не так, как у других культур, — сравнительно равномерно для формирования всех органов, а в большей степени сосредоточиваясь в корнях. Поэтому в ранние сроки развития бобовые растения, в отличие от злаковых, в большей степени удовлетворяют свои потребности в фосфоре за счет семядолей, а не запасов почвы. Чем крупнее семена, тем меньше бобовые растения зависят от фосфора почвы. Однако при симбиотическом способе существования потребность бобовых растений в фосфоре выше, чем при автотроф-ном. Поэтому при недостатке фосфора в среде у инокулированных растений ухудшается снабжение растений азотом.
Бобовые растения, как известно, выносят с урожаем значительно больше калия, чем другие сельскохозяйственные культуры. Поэтому калийные и особенно фосфорно-калийные удобрения существенно повышают продуктивность азотфиксации бобовыми растениями.
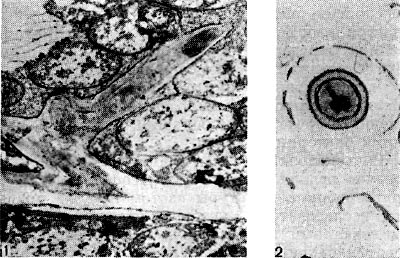
Рис. 166. Прекратившие функционировать интерцеллюлярная (1) и интрацеллюлярная (2) инфекционные нити в клубеньках клевера. Увел. X 10 000.
Положительное действие калия на образование клубеньков и интенсивность азотфиксации связано в значительной степени с физиологической ролью калия в углеводном обмене растения.
Кальций нужен не только для устранения излишней кислотности почвы. Он играет специфическую роль в развитии клубеньковых бактерий и обеспечении нормального симбиоза бактерий с растением-хозяином. Потребность клубеньковых бактерий в кальции частично может быть компенсирована стронцием. Интересно, что клубеньковые бактерии тропических культур, растущих на кислых латеритных почвах, не нуждаются в кальции. В этом опять проявляется экологическая адаптация клубеньковых бактерий, поскольку тропические почвы содержат очень небольшие количества кальция.
Для симбиотической азотфиксации необходимы также магний, сера и железо. При недостатке магния тормозится размножение клубеньковых бактерий, снижается их жизнедеятельность, подавляется симбиотическая азот-фиксация. Сера и железо оказывают также благоприятное влияние на образование клубеньков и процесс азотфиксации, в частности играя несомненную роль в синтезе леггемоглобина.
Из микроэлементов особо отметим роль молибдена и бора. При недостатке молибдена клубеньки плохо образуются, в них нарушается синтез свободных аминокислот и подавляется синтез леггемоглобина. Молибден вместе с другими элементами с переменной валентностью (Fe, Co, Си) служит посредником при переносе электронов в окислительно-восстановительных ферментных реакциях. При дефиците бора в клубеньках не формируются сосудистые пучки, и вследствие этого нарушается развитие бактероидной ткани.
На формирование клубеньков у бобовых растений большое влияние оказывает углеводный обмен растений, определяемый рядом факторов: фотосинтезом, наличием в среде углекислого газа, физиологическими особенностями растений. Улучшение углеводного питания благоприятно сказывается на инокуляционном процессе и азотонакоплении. С практической точки зрения большой интерес представляет использование соломы и соломистого свежего навоза для удобрения бобовых растений как источника углеводов. Но в первый год после внесения соломы в почву при ее разложении накапливаются токсические вещества. Следует отметить, что не все виды бобовых растений чувствительны к токсическим продуктам распада соломы; горох, например, не реагирует на них.
Определенное значение в симбиозе клубеньковых бактерий и бобовых растений имеют биологические факторы.
Большое внимание уделяется влиянию ризо-сферной микрофлоры на клубеньковые бактерии, которое может иметь как стимуляционный, так и антагонистический характер в зависимости от состава микроорганизмов ризосферы.
Много работ посвящено изучению фагов клубеньковых бактерий. Большинство фагов способны лидировать различные виды бактерий, некоторые специализированы лишь в отношении отдельных видов или даже штаммов клубеньковых бактерий. Фаги могут препятствовать внедрению бактерий в корень, вызывать лизис клеток в ткани клубенька. Фаги наносят большой ущерб, лизируя препараты клубеньковых бактерий на заводах, вырабатывающих нитрагин.
Среди различных видов насекомых, наносящих вред клубеньковым бактериям, особенно выделяется полосатый клубеньковый долгоносик, личинки которого разрушают клубеньки на корнях многих видов бобовых растений (главным образом однолетних). Широко распространен и щетинистый клубеньковый долгоносик.
Ранней весной самки клубеньковых долгоносиков откладывают от 10 до 100 яиц. Через 10—15 дней из яиц развиваются небольшие (до 5,5 мм), червеобразные, согнутые, белые, со светло-бурой головкой личинки, питающиеся преимущественно клубеньками и корневыми волосками. Только что вылупившиеся личинки проникают в клубенек и питаются его содержимым. Более взрослые личинки разрушают клубеньки снаружи. Одна личинка за 30—40 дней уничтожает 2—6 клубеньков. Особенно большой вред они наносят в сухую и жаркую погоду, когда развитие растений замедляется.
Клубеньки люцерны и некоторых других видов бобовых растений повреждает также большой люцерновый долгоносик.
Самки жука откладывают до 400 яиц, из которых развиваются безногие, дугообразные, желтовато-белые, с бурой головкой, покрытые бурыми щетинками личинки. Их длина 10— 14 мм. Цикл развития большого люцернового долгоносика протекает в течение двух лет.
Наличие нематод в корневой зоне различных видов бобовых растений отмечают многие исследователи. В прикорневой зоне гороха, например, обнаружено 47 видов нематод, среди них 25 паразитических.
На корнях молодых растений фасоли, люпина, клевера может паразитировать широко распространенная ростковая нематода. Самки этого вида, питающиеся корнями растений, откладывают яйца в ткани растения. Весь жизненный цикл развивающейся из яиц нематоды протекает обычно внутри тканей.
В степных районах на корнях люцерны, клевера и сои обнаружена степная нематода. Самки перед откладкой яиц проникают в корень, куда откладывают от 12 до 20 яиц. В корнях личинки проходят три личиночные стадии развития, нарушая функции корня и клубеньков.
Распространение клубеньковых бактерий в природе
Являясь симбиотическими организмами, клубеньковые бактерии распространяются в почвах, сопутствуя определенным видам бобовых растений. После разрушения клубеньков клетки клубеньковых бактерий попадают в почву и переходят к существованию за счет различных органических веществ подобно другим почвенным микроорганизмам. Почти повсеместное распространение клубеньковых бактерий является доказательством высокой степени их адаптируемости к различным почвенно-климатическим условиям, способности вести симбиотический и сапрофитный способ жизни.
Схематизируя имеющиеся к настоящему времени данные по распространению клубеньковых бактерий в природе, можно сделать следующие обобщения.
В целинных и окультуренных почвах присутствуют обычно в больших количествах клубеньковые бактерии тех видов бобовых растений, которые имеются в составе дикой флоры или культивируются длительное время в данной местности. Численность клубеньковых бактерий всегда наивысшая в ризосфере бобовых растений, несколько меньше их в ризосфере других видов и мало в почве вдали от корней.
В почвах встречаются как эффективные, так и неэффективные клубеньковые бактерии. Имеется много данных о том, что длительное сапрофитное существование клубеньковых бактерий, особенно в почвах с неблагоприятными свойствами (кислых, засоленных), ведет к снижению и даже утрате активности бактерий.

Рис. 167. Клубеньки на корнях ольхи (по Дж. Бекингу).
Перекрестная заражаемость разных видов бобовых растений нередко приводит в природе и сельскохозяйственной практике к появлению на корнях клубеньков, недостаточно активно фиксирующих молекулярный азот. Это, как правило, зависит от отсутствия в почве соответствующих видов клубеньковых бактерий.
Особенно часто такое явление наблюдается при использовании новых видов бобовых растений, которые либо заражаются неэффективными видами бактерий Перекрестных групп, либо развиваются без клубеньков.
Рис. 169. Клубеньки на корнях трибулюс (по Е. и О. Аллен).
Клубеньки у растений, не относящихся к бобовым
Корневые клубеньки или образования, напоминающие клубеньки, широко распространены на корнях не только бобовых растений. Они обнаружены у голосеменных и покрытосеменных двудольных растений.
Имеется до 200 видов различных растений, связывающих азот в симбиозе с микроорганизмами, образующими клубеньки на их корнях (или листьях).
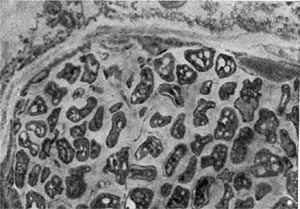
Рис. 168. Клубеньковая ткань ольхи (по Дж. Бекингу).
Клубеньки голосеменных растений (порядки Cycadales — саговники, Ginkgoales — гинкго-вые, Coniferales — хвойные) имеют ветвящуюся коралловидную, сферическую или четковидную форму. Они представляют собой утолщенные, видоизмененные боковые корни. Природа возбудителя, вызывающего их образование, до сих пор не выяснена. Эндофиты голосеменных растений относят и к грибам (фикомицетам), и к актиномицетам, и к бактериям, и к водорослям. Некоторые исследователи предполагают существование множественного симбиоза. Например, считают, что у саговников в симбиозе принимают участие азотобактер, клубеньковые бактерии и водоросли. Также не решен вопрос и о функции клубеньков у голосеменных. Ряд ученых пытается в первую очередь обосновать роль клубеньков как азотфиксаторов. Некоторые исследователи рассматривают клубеньки подокарповых как резервуары воды, а клубенькам саговников нередко приписывают функции воздушных корней.

Рис. 169. Клубеньки на корнях трибулюс (по Е. и О. Аллен).
У ряда представителей покрытосеменных двудольных растений клубеньки на корнях были обнаружены свыше 100 лет назад.
Сначала остановимся на характеристике клубеньков деревьев, кустарников и полукустарников (семейства Coriariaceae, Myricaceae, Be-tulaceae, Casuarinaceae, Elaeagnaceae, Rham-naceae), входящих в эту группу. Клубеньки большинства представителей данной группы — коралловидные гроздья розово-красного цвета, с возрастом приобретающие коричневую окраску. Имеются данные о наличии в них гемоглобина. У видов рода Elaeagnus (лоховые) клубеньки белого цвета.
Рис. 170. Клубеньки на корнях вейштка лесного (по И.Л. Клевенской).
Нередко клубеньки имеют большие размеры. У казуарин (Casuarina) они достигают в длину 15 см. Функционируют несколько лет.
Растения с клубеньками распространены в разных климатических поясах или приурочены к определенному ареалу. Так, Shepherdia и Ceanothus встречаются только в Северной Америке, Casuarina — преимущественно в Австралии. Значительно шире распространены лоховые и облепиха.
Многие растения рассматриваемой группы произрастают на бедных питательными элементами почвах — песках, дюнах, скальных породах, болотах.
Подробнее всего изучены клубеньки ольхи (Alnus), в частности A. glutinosa, обнаруженные еще в 70-х годах прошлого столетия М. С. Ворониным (рис. 167). Существует предположение, что клубеньки свойственны не только современным, но и вымершим видам ольхи, поскольку их находили на корнях ископаемой ольхи в третичных отложениях долины реки Алдана — в Якутии.
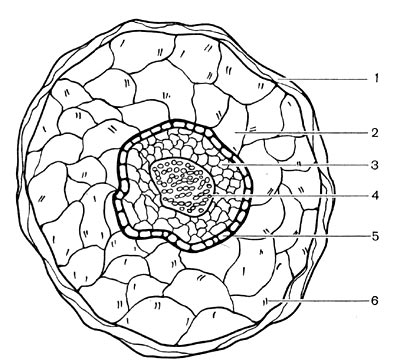
Рис. 171. Схема строения клубенька вейника лесного: 1 - кора, 2 — коровая паренхима; з — перициклическая паренхима; 4 - сосудистый пучок; 5 — эндодерма; 6 — бактерии (по И. Л. Клевенской).
Эндофит в клубеньках полиморфен. Он обычно встречается в виде гиф, везикул и бактероидов (рис. 168). Таксономическое положение эндофита до сих пор не установлено, поскольку многочисленные попытки выделить его в чистую культуру оказывались бесплодными, а если и удавалось выделить культуры, они оказывались невирулентными.
Основное значение всей этой группы растений, по-видимому, заключается в способности фиксировать молекулярный азот в симбиозе с эндофитом. Произрастая в областях, где разведение сельскохозяйственных растений с точки зрения экономики нерационально, они играют роль пионеров в освоении земли. Так, ежегодная прибавка азота в почве дюн Ирландии (мыс Верде) под посадками Casuarina equi-setifolia достигает 140 кг/га. Содержание азота в почве под ольхой на 30—50% выше, чем под березой, сосной, ивой. В высушенных листьях ольхи азота вдвое больше, чем в листьях других древесных растений. По расчетам А. Виртанена (1962), роща ольхи (в среднем 5 растений на 1 м2) дает за 7 лет прибавку азота 700 кг/га.
Значительно реже клубеньки встречаются у представителей семейства Zygophyllaceae (парнолистниковые). Впервые они были обнаружены Б. Л. Исаченко (1913) на корневой системе Tribulus terrestris. Позднее клубеньки были найдены и у других видов якор-цев.
Большинство представителей семейства Zygophyllaceae — ксерофитные кустарники или многолетние травы. Они распространены в пустынях тропических и субтропических областей, растут и на песчаных дюнах, пустошах и болотах умеренного пояса.
Интересно отметить, что такие тропические растения, как парнолистник ярко-красный, образуют клубеньки только при высокой температуре и низкой влажности почвы. Увлажнение почвы до 80% от полной влагоемкости препятствует формированию клубеньков. Как известно, у бобовых растений умеренного климата наблюдается обратное явление. При недостаточной влажности они не образуют клубеньков.
Клубеньки у растений семейства парнолист-никовых различаются размерами и расположением на корневой системе. Крупные клубеньки обычно развиваются на главном корне и близко от поверхности почвы. Более мелкие находятся на боковых корнях и на большей глубине. Иногда клубеньки образуются на стеблях, если они лежат на поверхности почвы.
Клубеньки у якорцев наземных на песках вдоль Южного Буга имеют вид мелких белых слегка заостренных или круглых бородавок.
Они обычно покрыты сплетением грибных гиф, проникающих внутрь коры корня.
У парнолистника ярко-красного клубеньки представляют собой концевые утолщения боковых корней растений. В клубеньках обнаруживаются бактероиды; бактерии очень напоминают клубеньковые.
Клубеньки тропических растений Tribulus cistoides твердые, округлые, около 1 мм в диаметре, соединены с корнями широким основанием, на старых корнях нередко мутовчатые. Чаще располагаются на корнях, чередуясь, с одной или с двух сторон (рис. 169). Для клубеньков характерно отсутствие зоны меристемы. Подобное явление отмечается при образовании клубеньков у хвойных растений. Клубенек поэтому возникает за счет деления клеток перицикла стелы.
Гистологическое изучение клубеньков Tribulus cistoides на разных стадиях развития показало, что в них отсутствуют микроорганизмы. На основании этого, а также скопления в клубеньках больших количеств крахмала их считают образованиями, выполняющими функцию обеспечения растений запасными питательными веществами.
Клубеньки вейника лесного — сферические или несколько удлиненные образования до 4 мм в диаметре, плотно сидящие на корнях растений (рис. 170). Цвет молодых клубеньков чаще всего белый, изредка розоватый, старых -желтый и бурый. Клубенек связан с центральным цилиндром корпя широким сосудистым пучком. Так же как и у Tribulus cistoides, клубеньки вейника имеют кору, коровую паренхиму, эндодерму, перициклическую паренхиму и сосудистый пучок (рис. 171).
Бактерии в клубеньках вейника лесного очень напоминают клубеньковых бактерий бобовых растений.
Клубеньки найдены на корнях капусты и редьки — представителей семейства крестоцветных. Предполагается, что их образуют бактерии, которые обладают способностью связывать молекулярный азот.
Среди растений семейства мареновых клубеньки встречаются у кофейных Coffea robusta и Goffea klainii. Они дихотомически ветвятся, иногда уплощены и имеют вид опахала. В тканях клубенька встречаются бактерии и бакте-роидные клетки. Бактерии, по мнению Стейар-та (1932), относятся к Rhizobium, но названы им Bacillus coffeicola.
Клубеньки у растений семейства розанных были обнаружены на дриаде (куропаточьей траве). У двух других представителей этого семейства — Purshia tridentata и Cercocarpus betuloides — описаны типичные коралловидные клубеньки. Однако никаких данных о строении этих клубеньков и природе их возбудителя в литературе пет.
Из семейства вересковых можно упомянуть только одно растение — медвежье ушко (или толокнянка), имеющее клубеньки на корневой системе. Многие авторы считают, что это коралловидные эктотрофные микоризы.
У покрытосеменных однодольных растений клубеньки распространены среди представителей семейства злаковых: лисохвоста лугового, мятлика лугового, волоснеца сибирского и волоснеца солончакового. Клубеньки образуются на концах корней; бывают продолговатыми, округлыми, веретеновидными. У лисохвоста молодые клубеньки светлые, прозрачные или полупрозрачные, с возрастом приобретают бурую или черную окраску. Данные о наличии бактерий в клетках клубеньков разноречивы.
Листовые клубеньки. Известно свыше 400 видов различных растений, образующих клубеньки на листьях. Наиболее хорошо изучены клубеньки у Pavetta и Psychotria. Они располагаются на нижней поверхности листьев вдоль основной жилки или рассеяны между боковыми жилками, имеют интенсивный зеленый цвет. В клубеньках сконцентрированы хлоропласты и танин. При старении на клубеньках часто появляются трещины.
Сформировавшийся клубенек заполнен бактериями, инфицирующими листья растения, очевидно, в момент прорастания семян. При выращивании стерильных семян клубеньки не возникают и растения развиваются хлоро-тичными. Выделенные из листовых клубеньков Psychotria bacteriophyla бактерии оказались принадлежащими к роду Klebsiella (К. rubiacearum). Бактерии фиксируют азот не только в симбиозе, но и в чистой культуре — до 25 мг азота на 1 г использованного сахара. Надо полагать, что они играют немаловажную роль в азотном питании растений на малоплодородных почвах. Есть основания полагать, что они снабжают растения не только азотом, но и биологически активными веществами.
Иногда на поверхности листьев можно увидеть глянцевые пленки или разноцветные пятна. Их образуют микроорганизмы филлосферы — особая разновидность эпифитных микроорганизмов, которые также участвуют в азотном питании растений. Бактерии филлосферы преимущественно олигонитрофилы (живут за счет ничтожных примесей азотсодержащих соединений в среде и, как правило, фиксируют небольшие количества молекулярного азота), тесно контактирующие с растением.
Свободноживущие азотфиксирующие микроорганизма. Азотобактер (AZOTOBACTER)
В 1901 году Бейеринк выделил из почвы аэробную неспорообразующую грамотрица-тельную бактерию, фиксирующую молекулярный азот, и назвал ее Azotobacter chroococcum (в родовом названии отражена способность бактерии фиксировать азот, в видовом — способность синтезировать коричневый пигмент — chroo и образовывать кокковидные клетки -coccum). Азотобактер — типичный представитель свободноживущих микроорганизмов. Свободноживущие — это все те микроорганизмы, которые живут в почве независимо от того, развивается вблизи растение или нет.
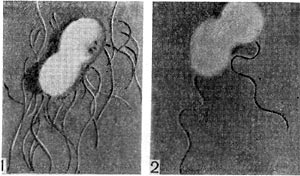
Рис. 173. Делящиеся клетки азотобактера (A. agilis), видны перитрихиалыше жгутики (7), у A. macrocyto-genes видны полярные жгутики (?) (по А. Бейлю и др.)-
Культуры азотобактера в лабораторных условиях отличаются полиморфизмом. Клетки разных видов азотобактера в молодом возрасте показаны на рисунке 172. Молодые клетки азотобактера подвижны; они имеют многочисленные или единичные жгутики (рис. 173). У азотобактера обнаружены выросты, подобные фимбриям (рис. 174). В старых культурах клетки азотобактера покрываются плотной оболочкой, образуя цисты. Они могут прорастать, давая начало молодым клеткам (рис. 175).
Полиморфизм азотобактера зависит в значительной степени от состава среды, на которой он выращивается. На среде с этиловым спиртом (в качестве единственного источника углерода) азотобактер длительное время сохраняет подвижность и форму палочек. В то же время на многих других средах полиморфизм проявляется очень резко.
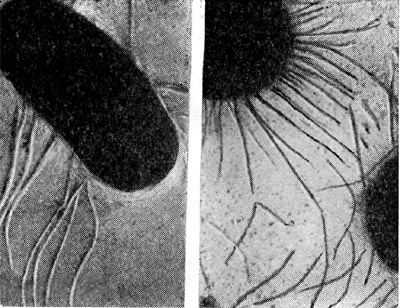
Рис. 174. Фимбрпоподобные образования у клеток азотобактера. Увел. X 24 000. (По Э. В. Болтянской.)
На плотных питательных средах, не содержащих азота, азотобактер образует крупные слизистые, иногда морщинистые колонии (рис. 176), окрашивающиеся при старении в желтовато-зеленоватый, розовый или коричнево-черный цвет. Колониям разных видов азотобактера присуща своя специфическая пигментация.
К настоящему времени известен ряд видов азотобактера: Azotobacter chroococcum, Az. beijerinckii, Az. vinelandii, Az. agilis, Az. nigricans, Az. galophilum.
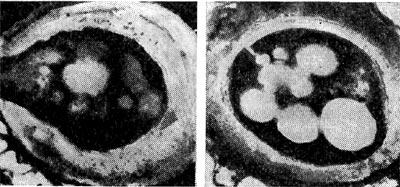
Рис. 175. Цисты азотобактера (по И. Чану и др.). Зрелая циста, наполненная гранулами жира и окруженная толстой плотной оболочкой (справа), и прорастающая циста (растущая молодая клетка разрывает оболочку цисты — слева). Увел. X 35 000.
Источником азота для азотобактера могут служить разнообразные минеральные (соли аммония, азотной и азотистой кислот) и органические (мочевина, различные аминокислоты) соединения. Однако если азотобактер развивается только за счет связанного в среде азота, он не выполняет своей основной функции — фиксации молекулярного азота. Азотобактер обычно фиксирует до 10—15 мг молекулярного азота на 1 г использованного источника углерода (например, глюкозы, сахарозы). Эта величина сильно колеблется в зависимости от условий выращивания культуры, состава питательной среды, ее кислотности, температуры, аэрации.
По отношению к источникам углерода В. Л. Омелянский (1923) назвал азотобактер полифагом («всеядным»).
Рис. 176. Развитие колоний A. chroococcum вокруг комочков почвы па безазотной среде.
Азотобактер хорошо усваивает разнообразные углеводы (моно- и дисахара, некоторые полисахариды), органические кислоты, многоатомные спирты (глицерин, маннит) и другие вещества.
Многим исследователям удавалось выращивать азотобактер в чашках с питательной средой без азота и углерода, если чашки были помещены в камеру, где находились пары ацетона, этилового спирта или некоторых других органических соединений. В присутствии легкодоступных форм углеродсодержащих соединений азотобактер может частично использовать углекислоту из атмосферы. Повышение концентрации углекислого газа до 0,5% в воздухе несколько стимулирует развитие азотобактера. Но азотобактером лучше усваиваются легкодоступные формы углеродсодержащих органических соединений. В почве запас подвижного органического вещества невелик, поэтому именно недостаток легкодоступных соединений углерода в первую очередь ограничивает развитие азотобактера в природных условиях.
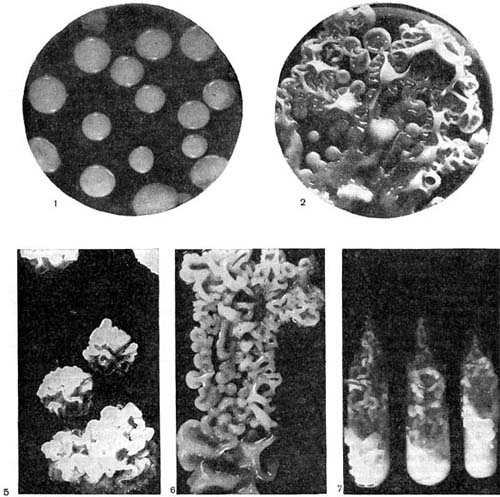
Рис. 177. Колонии бейеринкии разных типов (гладкие и складчатые варианты): 1—4, 6—8, 10 — по Н. И. Гогорикидзе; 5, 9, 11 — по Дж. Бекингу.
Какие же органические соединения может использовать в почве азотобактер? Перегнойные вещества почвы азотобактером практически не усваиваются. Поэтому в почвах, даже очень богатых перегноем, при отсутствии свежих органических остатков интенсивного размножения азотобактера не происходит.
Однако, если в почве имеются органические соединения и продукты распада растительных и животных клеток, азотобактер развивается хорошо. В частности, он усиленно размножается в почвах, удобренных соломой и соломистым навозом, а также в разнообразных компостах, содержащих целлюлозу. Азотобактер хорошо ассимилирует вещества, образующиеся при распаде целлюлозы.
Развитие азотобактера и фиксация им азота в значительной степени зависят от наличия в среде фосфора. Источником фосфора могут служить как органические, так и минеральные фосфорсодержащие соединения. Высокая чувствительность азотобактера к фосфору позволила разработать микробиологический метод определения потребности почв в фосфорных удобрениях.
В качестве тест-организма в этом методе используется азотобактер. Микробиологические методы определения потребности почвы в удобрении имеют ряд преимуществ перед химическими анализами, хотя, безусловно, уступают в точности.
Важную роль в обмене веществ азотобактера играет кальций. Этот элемент необходим азотобактеру при питании как молекулярным, так и аммонийным азотом (Г. Н. Зайцева, 1965). Недостаток кальция в среде приводит к сильной вакуолизации клеток и их вздутию.
Высокая чувствительность азотобактера к кальцию, так же как и к фосфору, используется для определения потребности почв в известковании.
Микроэлементы (молибден, бор, ванадий, железо, марганец) необходимы азотобактеру в первую очередь для осуществления процесса азотфиксации. Потребность в микроэлементах определяется в значительной степени геохимическими условиями существования азотобактера в почвах. Штаммы микроорганизма, выделенные из почв с высоким естественным содержанием того или иного микроэлемента, нуждаются, как правило, в более высоких концентрациях этих элементов.
Интересно, что радиоактивные элементы (радий, торий, уран) оказывают стимулирующий эффект на развитие азотобактера и процесс азотфиксации.
Азотобактер чрезвычайно чувствителен к реакции среды. Оптимальная для его развития область рН 7,2—8.2. Однако азотобактер способен развиваться и на средах с рН от 4,5 до 9,0; кислая реакция среды неблагоприятно действует на его развитие. Из кислых почв выделяются неактивные формы азотобактера, утратившие способность связывать молекулярный азот.
Большое влияние на развитие азотобактера оказывает влажность почвы. Клетки азотобактера имеют меньшее осмотическое давление, чем клетки грибов и актиномицетов; потребность во влаге аналогична потребности высших растений. Азотобактер распространен в пресных водоемах, илах, затопляемых рисовых полях, сточных водах, сильно увлажненных почвах, на водных растениях в прудах и водохранилищах. Это свидетельствует о его высокой степени гидрофильности. На основании высокой потребности во влаге почвенных форм азотобактера предполагается, что предки некоторых морских и почвенных видов азотобактера могли быть общими.
В отношении температуры азотобактер является типичным мезофильным организмом, с оптимумом развития около 25—30 °С. Понижение температуры азотобактер переносит хорошо, поэтому зимой даже в северных широтах численность его клеток в почве заметно не уменьшается.
Из биологических факторов, влияющих на развитие азотобактера, следует прежде всего отметить почвенные микроорганизмы. Они могут оказывать влияние на жизнедеятельность азотобактера в почве косвенно, изменяя, например, рН или окислительно-восстановительные условия, и непосредственно, вырабатывая питательные и биологически активные вещества. Так, активирующее влияние целлюлозоразру-шающих и маслянокислых микроорганизмов на развитие азотобактера и его антагонистические отношения с представителями почвенной микрофлоры отмечали многие советские и зарубежные исследователи. Биоценоз микроорганизмов, формирующийся в условиях той или иной почвы, меняется в значительной степени под влиянием растительного покрова. И азотобактер как член биоценоза также зависит от этого фактора. С помощью метода радиоавтографии установлено, что при нанесении меченных по фосфору клеток азотобактера на семена зерновых культур клетки обычно концентрируются вокруг растущей корневой системы проростков.
Имеются, однако, данные, что клеток азотобактера в ризосфере растений очень мало. В самом лучшем случае (при полном отсутствии антагонистов и благоприятных окружающих условиях) их количество не превышает 1 % от общего числа ризосферной микрофлоры.
Культуры азотобактера, как правило, образуют значительное количество биологически активных веществ: витамины группы В, никотиновую и пантотеновую кислоты, биотин, гетероауксин и гиббереллин. Однако, несмотря на то что культуры азотобактера вырабатывают целую серию биологически активных веществ, внесение витаминов, гиббереллина и гетероауксина в среду ускоряет рост азотобактера. Реакция на дополнительное внесение витаминов в среду является индивидуальной особенностью штаммов.
Азотобактер может продуцировать ростовые вещества типа ауксинов. Это подтверждается опытами, в которых было установлено образование дополнительных корешков у черенков фасоли под влиянием ауксинов, вырабатываемых азотобактером. Биологический тест — карликовая форма гороха сорта Пионер — позволяет определить в культуре азотобактера гиббереллиноподобные соединения.
Все эти соединения в совокупности способны стимулировать прорастание семян растений и ускорять их рост в тех, конечно, случаях, когда на корневой системе растений находится достаточное количество клеток азотобактера.
Кроме того, была обнаружена антагонистическая активность азотобактера по отношению к возбудителям бактериальных болезней растений. Азотобактер синтезирует фунгистати-ческий (задерживающий развитие грибов) антибиотик группы анисомицина. Ряд грибных организмов, встречающихся на семенах и в почве (виды из родов Fusarium, Alternaria, Penicillium), может угнетать развитие многих видов растений, особенно в холодную погоду. Азотобактер, продуцируя противогрибные антибиотические вещества, помогает растениям ра и развиваться, что имеет особенно болы значение в ранние фазы развития.
К сожалению, способность азотобактера тивно размножаться в почве и проявлять с: многогранные качества весьма ограничена за дефицита легкодоступных органических ществ в почве и высокой требовательности мироорганизма к окружающим условиям. Поэте стимулирующий эффект азотобактера проявляется лишь на плодородных почвах.
Распространение азотобактера в почвах Советского Союза имеет определенные закономерности. В целинных подзолах и дерново-подзолистых почвах, характеризующихся кислой реакцией, условия для развития азотобактера неблагоприятны. Только окультуривание таких почв создает возможности для его развития. В почвах с повышенным увлажнением и преобладанием луговой растительности (почвы пойм) азотобактер обычно встречается в течение всего вегетационного периода в больших количествах. В торфяниках азотобактер или отсутствует, или развивается очень слабо. В зоне достаточно увлажненных северных мощных черноземов азотобактер развивается хорошо, а в зоне обычных и южных черноземов при отсутствии орошения, а также в целинных и неполивных окультуренных каштановых почвах только как весенний эфемер. Максимальное развитие азотобактера в весенний период наблюдается и в целинных и в богарных почвах сероземной зоны. В солонцах и солончаках распространены преимущественно солестойкие расы азотобактера. В основном в почвах нашей страны доминирует Az. chroococcum.
Бейеринкия (BEIJERINCKIA)
Впервые аэробные бактерии рода Beijerinckia были выделены из кислых почв рисовых полей в Индии (в 1939 г.). Г. Деркс (1950), обнаружив эту бактерию в почве Ботанического сада в Богоре (Ява), предложил назвать ее именем М. Бейеринка — одного из первых исследователей фиксаторов азота.
Клетки бактерий рода Beijerinckia имеют круглую, овальную или палочковидную формы; палочки иногда искривлены. Размеры молодых клеток 0,5—2,0 X 1,0—4,5 мкм. Встречаются подвижные и неподвижные формы. Цист и спор не образуют. Культуры характеризуются медленным ростом. Типичные колонии формируются обычно через 3 недели при 30 °С. Большинство культур Beijerinckia образует на безазотном агаре с глюкозой выпуклые, нередко складчатые, блестящие слизистые колонии очень вязкой консистенции (рис. 177). При старении культуры, как правило, образуют темноокрашенный пигмент.
На 1 г использованного энергетического материала организмы рода Beijerinckia фиксируют 16—20 мг молекулярного азота. Спектр углеродсодержащих соединений, доступных бейеринкии, значительно уже, чем у азотобактера. Хорошо используются моно- и дисаха-риды, хуже — крахмал, органические кислоты, ароматические вещества не усваиваются. Минеральный азот и многие аминокислоты бактерии рода Beijerinckia предпочитают молекулярному азоту.
Основные отличия бейеринкии от азотобактера— высокая кислотоустойчивость(могут расти даже при рН 3,0), кальцефобность (ничтожные дозы кальция подавляют рост), устойчивость к высоким концентрациям железа, алюминия.
Бактерии рода Beijerinckia широко распространены в почвах южной и тропической зоны, реже встречаются в зоне умеренного климата. Beijerinckia часто встречается на поверхности листьев тропических растений в Индонезии.
Раньше полагали, что бактерии рода Beijerinckia могут существовать только в кислых почвах. Сейчас установлено, что они неплохо развиваются и в нейтральных и щелочных почвах. Тем не менее следует полагать, что Beijerinckia играют значительную роль в азотном балансе главным образом кислых почв (латеритах, красноземах), не имея существенного агрономического значения для нейтральных почв.
Клостридиум (CLOSTRIDIUM)
Первый анаэробный микроорганизм, усваивающий молекулярный азот, был выделен и описан С. Н. Виноградским в 1893 г. Он оказался спорообразующей бактерией, которой было дано наименование Clostridium pasteurianum (родовое название происходит от латинского слова clostrum — веретено; видовое — pasteurianum — дано в честь Луи Пастера).
Клетки Cl. pasteurianum крупные, их длина 2,5—7,5 мкм, ширина 0,7 —1,3 мкм. Располагаются они поодиночке, парами или образуют короткие цепочки. Молодые клетки подвижны, имеют перитрихиально расположенные жгутики, плазма их гомогенна. При старении клетки плазма становится гранулированной, в ней накапливается гранулеза (вещество типа крахмала). В центре клетки или ближе к ее концу формируется спора, которая в поперечнике значительно шире, чем вегетативная клетка, и поэтому клетка в этот период приобретает форму веретена. Размер спор 1,3 х 1,6 мкм. На рисунке 178 изображены клетки Cl. pasteurianum со спорами. Морфология спор и поведение ядерного вещества в процессе спорообразования у клостридиев детально описаны на стр. 228 В. И. Дудой.
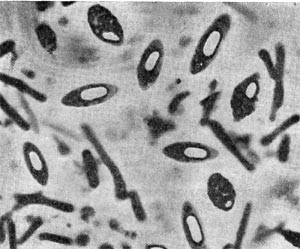
Рис. 178. Клетки Clostridium pasteurianum со спорами. Увел. X 3500 (по В.И. Дуде).
Азотфиксирующая функция выявлена у многих представителей рода Clostridium: Cl. pasteurianum, Cl. butyricum, Cl. butylicum, Cl. beijerinckia, Cl. pectinovorum, Cl. acetobutyli-cum и других видов. Наиболее энергичный азотонакопитель — Cl. pasteurianum — фиксирует 5—10 мг азота на 1 г потребленного источника углерода.
Наряду с молекулярным азотом бактерии рода Clostridium хорошо усваивают минеральные и органические азотсодержащие соединения. В качестве источника углеродного питания бактерии рода Clostridium используют различные соединения, которые обычно одновременно служат для них и источником энергии. К фосфору, калию и кальцию они значительно менее чувствительны, чем азотобактер. Однако удобрение почв фосфорно-калийными солями, известкование почв или компостов всегда приводит к возрастанию численности.
Клостридии относительно устойчивы к кислой и щелочной реакции среды. Область рН, при которой их развитие протекает нормально, довольно широка; минимальное значение рН ниже 4,5, максимальное — выше 8,5.
Влияние воздушно-водного режима на развитие бактерий рода Clostridium изучено достаточно полно. Будучи анаэробными, они хорошо переносят высокое насыщение почвы влагой. Однако оптимальная степень увлажнения для них определяется типом почвы и обеспеченностью органическим веществом. Лучше всего клостридий развивается при влажности почвы, равной 60—80% от полной вла-гоемкости.

Таблица 46. Бактериоз овса и суданской травы: 1 — бурый (красный) бактериоз овса; 2 — бактериоз суданской травы.
Больше всего бактерий рода Clostridium в верхних слоях почвы, которые богаты органическими веществами.
Бактерии рода Clostridium но-разному относятся к температуре, встречаются как мезофильные. так и термофильные бактерии. Молекулярный азот фиксируют лишь мезофилы.
У мезофильных форм оптимальная температура развития чаще всего находится в диапазоне 25—30 °С. Предел максимальных температур 37—45 °С.

Таблица 47. Болезни хлопчатника, табака и свеклы: 1 — гоммоз хлопчатника; 2 — бактериальная рябуха табака; 3 — серебристая болезнь свеклы (справа — пятна при увеличении).
Споры клостридиев весьма устойчивы к высоким температурам. Они выдерживают нагревание при 75 °С в течение 5 ч и в течение 1 ч нагревание при 80 °С. Споры термофильных клостридиев погибают при кипячении через 30 мцн. Более высокая температура (110 °С) быстро убивает их.
Со многими микроорганизмами в почве Clostridium находится в метабиотических отношениях, при которых предполагается обмен продуктами метаболизма. Так, азотобактер улучшает условия жизни клостридия, поглощая кислород, а клостридий вырабатывает из органических соединений, недоступных азотобактеру, органические кислоты, которые может ассимилировать азотобактер.
Было бы трудно ответить на вопрос: в каких почвах нет Clostridium? «Всеядность» Clostridium, малая взыскательность к условиям внешней среды, а также способность в неблагоприятных условиях переходить в состояние спор объясняют их широкое, практически повсеместное распространение.
Накопления азота в почвах за счет деятельности Clostridium, однако,невелики и не превышают, как правило, нескольких килограммов на один гектар почвы.
Другие роды азотфиксирующих бюактерий
До недавнего времени считалось, что монополия азотфиксации принадлежит только представителям родов Azotobacter, Clostridium и Rhizobium.
Правда, еще до выделения М. Бейеринком (1901) азотобактера и почти одновременно с С. Н. Виноградским (1895) клостридия французский исследователь Бертло (1885—1892) описал большое количество разнообразных почвенных микроорганизмов, обладающих азотфиксирующей функцией. Некоторые из них повышали содержание азота в среде на 80% (от исходного). Однако отсутствие в ряде случаев идентификации выделенных культур и несовершенство используемых Берт-ло методик не давали права согласиться с утверждениями о значительной широте распространения азотфиксирующей функции среди почвенных микроорганизмов.
За последнее время использование высокочувствительного изотопного метода и других точных приемов исследовании позволило установить способность многих почвенных микроорганизмов связывать атмосферный азот. Список азотоусвоителей пополнился новыми видами бактерий: Azotomonas insolita, Azotomonas fluorescens, Pseudomonas azotogensis. Установлена азотфиксирующая способность у ряда известных бактерий, таких, как актиномицеты (Actinomycetes), фотосинтезирующие бактерии (Rhodospirillum rubrum), представители эубак-терий (семейств Thiorhodaceae, Athiorhoda-сеае, а также родов: Pseudomonas, Bacterium, Bacillus). Наконец, выявлено, что некоторые виды микроорганизмов, не фиксирующие азот в обычных условиях культивирования, могут стать энергичными азотфиксаторами в ассоциациях с другими видами микроорганизмов.
Сейчас известно свыше 80 видов и разновидностей бактерий, несколько видов актиномице-тов, дрожжей, дрожжеподобных организмов и плесневых грибов, способных фиксировать азот. Они населяют почву, дно морей и пресных водоемов.
Остановимся на характеристике лишь основных представителей бактерий.
Способность фиксировать азот присуща ряду представителей семейства Pseudomonadaceae. Они довольно широко распространены в природе. К наиболее интересным представителям этого семейства относится несколько видов: Azotomonas insolita, фиксирующий до 12 мг азота на 1 г использованного сахара и встречающийся нередко не только в почве, но и как эпифит на растениях; Azotomonas fluorescens, выделенный впервые из компостов Н. А. Красильниковым (1945), продуктивность азотфиксации которого не меньше, чем у первого вида; Pseudomonas azotocolligans, населяющий кислые и щелочные почвы Америки; Pseudomonas azotogensis, широко распространенный в почвах Канады и легко выделяющийся из парниковых почв, и, наконец, Pseudomonas methanitrificens, который встречается в почвах, имеющих выход источников природных газов. Последняя бактерия особенно интересна тем, что она использует метан и другие газообразные углеводороды в качестве единственного источника углерода, за счет энергии разложения которых она усваивает азот атмосферы.
Представители семейства Spirillaceae, фиксирующие молекулярный азот, распространены преимущественно в рыбоводных прудах, озерах, морской воде, морских отложениях. Возможно, они играют немаловажную роль в фиксации азота в водоемах.
Не только азотобактеру, как члену семейства Azotobacteriaceae, свойственна азотфиксирующая функция. В почвах Индии встречаются еще два представителя этого семейства — Derxia gummosa и Derxia indica — активные, хотя и медленнодействующие, азотфиксаторы. В азотном балансе почв они, как и бактерии Agrobacterium radiobacter из семейства Rhizo-biaceae, по-видимому, не играют сколько-нибудь значительной роли. Молекулярному азоту они предпочитают связанные источники азота, такие, как мочевина, пептон, аминокислоты и минеральные соединения.
Среди спорообразующих грамположительных бактерий семейства Bacillaceae азотфиксирующая способность выявлена у факультативных анаэробов Bacillus polymyxa, аэробов Bacillus megaterium и Thermobacillus azotofigens. Последняя бактерия, выделенная из удобренной навозом дерново-карбонатной почвы Эстонской ССР, оказалась термофильной с оптимумом роста 45—50 °С и максимумом 60—65 °С. При температурах ниже 20 °С она не развивается.
Распространение функции азотфиксации в ряде семейств фотосинтезирующих бактерий (семейства Thiorhodaceae, Athiorhodaceae, Chlo-robacteriaceae, Hyphomicrobiaceae) не случайно, так как, по-видимому, они являются представителями одной из древнейших групп азотфиксаторов на Земле.
Небольшие количества молекулярного азота способны усваивать почвенные микобактерии. Усвоенный микобактериями азот в сочетании с азотом, ассимилированным другими олиго-нитрофильными микроорганизмами, сине-зелеными водорослями, лишайниками и мхами, настолько обогащает примитивную почву азотом, что ее могут заселять высшие растения.
Механизм биологической фиксации молекулярного азота
Как известно, атомы в молекуле азота (N2) соединены тремя ковалентными связями, энергия диссоциации которых равна 9,4 • 105 дж/молъ. Наибольшей энергией — 5,3-105 дж/молъ — обладает первая связь, вторая — 2,5-105 дж/молъ, третья — 1,6 • 105 джмолъ. Эти связи очень прочны, и молекулы азота поэтому химически инертны. Именно инертность азота обусловливает необходимость его активации, так же как и повышения химической активности вступающего с ним в реакцию соединения или элемента.
Синтез аммиака из атмосферного азота химическим путем, осуществляемый методом Габе-ра — Боша, происходит при температуре 400— 500 °С и высоком давлении (200—1000 атм). Клетки микроорганизмов проводят процесс азотфиксации в обычных условиях.
Каким образом фиксируют азот микроорганизмы, если и здесь сохраняется в силе требование больших энергетических затрат для активации молекулы азота? Может быть, их энергетический обмен дает такую возможность? В самом деле, у азотфиксаторов, как указывает В. Л. Кретович (1964), интенсивность энергии обмена, в частности степень потребления кислорода, значительно выше, чем у бактерий, неспособных фиксировать азот. И ферменты у них более активные. Однако, каким путем эта энергия используется в процессе азотфик-сации, до сих пор еще точно не установлено. В современных гипотетических схемах механизма азотфиксации несомненное предпочтение отдается восстановительному характеру превращений молекулярного азота, о чем в 20-е годы этого столетия утверждали наши замечательные соотечественники С. П. Костычев и С. Н. Виноградский, выдвигая «аммиачную теорию» фиксации атмосферного азота. У всех свободноживущих азотфиксирующих микроорганизмов, а также и при симбиотиче-ской азотфиксации аммиак (NHs) обнаружен в качестве первого стабильного продукта этого процесса.
Наиболее вероятно, что разрыв связей в молекуле азота происходит не сразу, а последовательно, в результате действия ферментных систем.
В. Е.Шилов и Г.И.Лихтенштейн (1971) предложили интересный механизм активации азота ферментом нитрогеназой (рис. 179). Молекулярный азот через щель размером 4—5 А (это соответствует длине молекулы азота) поступает внутрь фермента и здесь активируется. В его активации большая роль принадлежит молибдене- и железосодержащим центрам, по цепям атомов которых происходит эстафетная передача активирующих азот электронов от восстановителя. Реакции активации способствует близость группировок серы.
В результате активации и хемосорбции азота нитрогеназой высвобождается энергия и происходит разрыв двух связей в молекуле азота. На это расходуется 7,8*105 дж/моль. Третья связь разрывается при внедрении в молекулу активированного азота: водорода, активированного, в свою очередь, ферментами дегидрогена-зной и гидрогеназной систем. Получающийся аммиак или другие восстановленные продукты азота реагируют с кетокислотами, образуя аминокислоты.
В симбиотических азотфиксирующих системах фиксация азота осуществляется в результате сложного взаимодействия микроорганизма и высшего растения. Несомненно, механизм процесса азотфиксации в клубеньках имеет своеобразные особенности, обусловленные совместным функционированием двух совершенно различных по своим свойствам партнеров, присутствием леггемоглобина, принимающего участие в процессе фиксации, и наличием бактероидов.
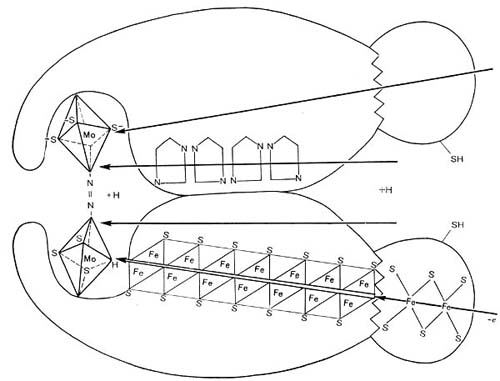
Рис. 179. Схема действия нитрогеназы.
Процесс фиксации в симбиотической системе иллюстрируется схемой (рис. 180), где видно, что растение и бактерии функционируют в единстве и что электрон-транспортной цепью между ними является леггемоглобин.
Высшее растение по схеме является источником углеродсодержащих соединений. Их трансформация обеспечивает получение энергетического материала для процессов активации и восстановления N2. Активированный азот — конечный акцептор электронов. Продукты неполного окисления углеродсодержащих соединений служат акцепторами NHs и в клубеньках образуют аминокислоты, которые становятся доступными высшему растению. Растения выполняют роль накопителя углеродсодержащих соединений (продуктов фотосинтеза) и поставщика энергии. Клубеньковые бактерии в стадии бактероидов проявляют способность с помощью нитрогеназы переносить активированный водород к азоту. Путь от Na до NHs рассматривается как восстановительный процесс.
В последнее время получены доказательства локализации процесса азотфиксации в бактероидах с помощью измерения азотфиксирую-щей активности у фракции бактероидов, которую отделяли центрифугированием от других фракций клубенька.
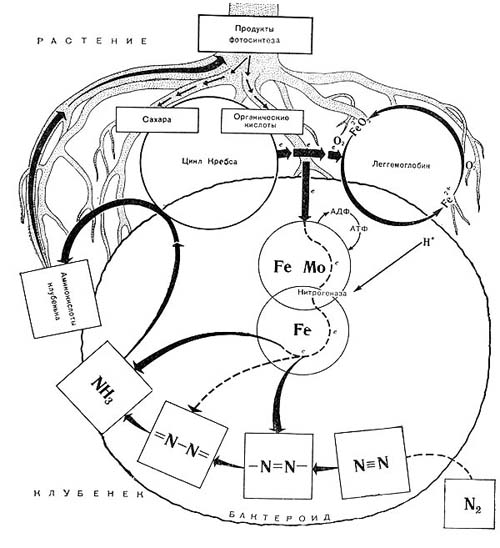
Рис. 80. Схема симбиотической азотфиксации
Бактериальные удобрения
От наличия клубеньковых бактерий в почве зависит исход естественного заражения бобовых растений. При отсутствии в почве соответствующих видов клубеньковых бактерий бобовые растения развиваются без клубеньков и не выполняют функции азотонакопителей, становясь потребителями почвенного азота.
Такие случаи в природе довольно редки. Как правило, они более характерны тем видам растений, которые не заражаются перекрестно клубеньковыми бактериями других видов (соя, фасоль, люпин). Однако при введении в сельскохозяйственную практику новых для данного района видов бобовых культур подобное явление может наблюдаться сравнительно часто.
Обычно в почве присутствуют местные, или, как их иногда называют, «спонтанные», «аборигенные», расы клубеньковых бактерий, заражающих растения. Эффективность естественной инокуляции местными клубеньковыми бактериями может быть и высокой, и очень низкой. Во всяком случае, основную роль здесь играет фактор случайности.
В связи с этим в практику сельского хозяйства прочно вошел прием инокуляции — предпосевная обработка семян бобовых растений препаратом клубеньковых бактерий соответствующего вида. В разных странах технический препарат для инокуляции бобовых растений получил разные наименования. В СССР, ГДР, ФРГ и Польше он назван нитрагином. Отсюда прием инокуляции соответствующих культур в этих странах называется нитраги-низацией. Нитрагин повышает урожай бобовых растений на 10—15%, а в новых районах возделывания — на 50% и более.
Если исходить из средней прибавки урожая 15%, то можно рассчитать, какое количество молекулярного азота связывается биологическим путем в процессе симбиотической азот-фиксации. Л. М. Доросинский, считая, что 304 000 т азота фиксируется симбио-тическими системами дополнительно за счет азота атмосферы, оценивает возможности симбиотической фиксации азота цифрой 2 335 000 т, что равноценно внесению 11 000 000 т сернокислого аммония. К тому же следует учесть, что в почве остается 484 500 т азота,— это эквивалентно 2250 000 т сернокислого аммония.
Нитрагин способствует активному накоплению азота воздуха бобовыми растениями, улучшает качество урожая этих культур, увеличивая в них содержание белка, аминокислот, витаминов группы В. Нитрагин снижает возможность заражения растений грибными и бактериальными заболеваниями, увеличивает накопление азота в почве.
Технические препараты нитрагина выпускаются в различном виде. По физическому составу они могут быть сыпучими (почвенные, торфяные), жидкими (бульонные), плотными (агаровые). Эти различия определяются природой используемого инертного наполнителя или так называемого вещества-носителя. В качестве наполнителей используются агар, желатин, древесный уголь, глина, перегной, песок, каолин, бентонит, торф, сенная мука, компост из бобовых растений, мелко нарезанная солома.
Инокулянты могут быть влажными и сухими. Сухие препараты, как правило, получают путем лиофилизации (высушиванием из замороженного состояния).
Трудности хранения, транспортировки и применения агаровых и бульонных препаратов нитрагина, а также небольшой срок их годности являются серьезными причинами, способствующими вытеснению этого препарата из производства. Сыпучие порошковидные препараты нитрагина обладают несомненными преимуществами по сравнению с агаровыми и бульонными. Технология их изготовления проще и экономичнее. Торфяные культуры дольше хранятся и легче транспортируются. Они защищают клетки клубеньковых бактерий от непосредственного контакта с удобрениями и сохраняют их в жизнеспособном состоянии на семенах, особенно при гранулировании семян с известью.
В последние годы наибольшее распространение получили торфяные препараты. Наличие в торфе большого количества питательных веществ, высокая адсорбционная способность торфа и ряд других физических свойств обусловливают его ценность не только как наполнителя, но и как среды для размножения клубеньковых бактерий.
Торфяные препараты широко применяются в США, Австралии, Новой Зеландии, Канаде, Индии и ряде стран Европы. Они особенно широко используются в виде дустов.
Почвенные препараты нитрагина изготовляются и применяются весьма широко в европейских странах. В Советском Союзе производство почвенного нитрагина также осуществляется, но в меньших масштабах, чем производство сухого (лиофилизированного) нитрагина. Сухой нитрагин представляет собой порошок каолина (или бентонита), в 1 г которого содержится для обработки мелкосеменных культур (клевер, люцерна) от 3 до 6 млрд. клеток бактерий, а для крупносеменных (горох, люпин) — 1,5—3,0 млрд. клеток.
На выживаемость клеток клубеньковых бактерий при высушивании и последующем их хранении влияют состав и дозы используемых при выращивании бактерий сред или отдельных веществ. Некоторые из таких сред получили название «защитных», поскольку они выполняют функцию сохранения клеток клубеньковых бактерий в анабиотическом состоянии! Состав защитных (протективных) сред весьма разнообразен (обезжиренное молоко, кровяная сыворотка, сухая кровь, сахарозо-желатиновая среда).
Для изготовления нитрагина требуются высокоактивные, вирулентные и конкурентоспособные штаммы клубеньковых бактерий.
Применять нитрагин следует только для соответствующего вида растения или перекрестно заражаемого. Например, семена гороха можно обработать препаратом, приготовленным для обработки вики, чечевицы, чины, кормовых бобов; семена люцерны — нитрагином, предназначенным для обработки донника, и наоборот. Однако нельзя обрабатывать семена гороха нитрагином, предназначенным для донника или люцерны, так как горох и люцерна входят в разные перекрестнозаражающиеся группы.

Таблица 48. Бурый бактериоз фасоли (1-3) и кольцевая гниль клубней картофеля.
В последние годы делаются попытки разработки новых методов инокуляции бобовых культур. Предполагается заменить процесс нитра-гинизации семян обработкой клубеньковыми бактериями цветковых завязей растений на семенных посевах бобовых культур. В этом случае гарантируется получение уже заранее инокулированного семенного материала.

Таблица 49. Бактериоз огурцов: 1 - больной лист (справа - пятна при большом увеличении); 2 - больные плоды (справа язвочка при большом увеличении)
Заслуживает внимания разработка методов предварительной инокуляции семян бобовых культур и использование «мультипрепарата», готовящегося на двух или нескольких культурах клубеньковых бактерий.
Азотобактерин — препарат азотобактера, предназначенный для обработки разных видов сельскохозяйственных растений. В 1 г такого удобрения должно содержаться не менее 40 млн. клеток азотобактера. Его применение было начато в Советском Союзе в 30-е годы по рекомендации С. П. Костычева.
В большинстве случаев на дерново-подзолистых почвах и черноземах азотобактерин повышает урожай растений на 6 —10%. На унавоженных почвах положительный эффект азотобактерина возрастает.
Действие азотобактерина на растение многогранно: вероятно, он не столько улучшает азотное питание, сколько усиливает витаминный обмен, продуцируя биологически активные вещества, и способствует развитию растений, подавляя грибную флору зоны корня вырабатываемыми им фунгистатическими веществами.









